
����Ŀ�������½�������ʵ�飬����ʵ��������������õ��Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | ��X��Һ�еμ� | X��Һ��һ������ |
B | ��Ũ�Ⱦ�Ϊ0.05mol��L-1�� |
|
C | ��2mLŨ�Ⱦ�Ϊ0.05mol��L-1�� |
|
D | �� | ��� |
A.AB.BC.CD.D
���𰸡�CD
��������
A�������İ�ɫ�����������Ȼ�������A����
B��������ɫ������˵����ͬ������Cu(OH)2�ܽ�ȸ�С�������׳���������Ϊͬ���ͳ������ܽ��ԽС���ܶȻ���ԽС������Ksp[Mg(OH)2]<Ksp[Cu(OH)2]����B����
C������ʵ�����������I2���ɣ���ˮ��������������I-��˵��I-�Ļ�ԭ�Ը�ǿ����C��ȷ��
D����Һ����壬˵��������̼���Ʒ�Ӧ�����˱����ƣ���CO32-��ȡ�˱��ӵ������ӣ����Խ�������ӵ�����![]() <CO32-����D��ȷ��
<CO32-����D��ȷ��
�ʴ�ΪCD��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ɷ�FeS2������ͭ��(��Ҫ�ɷ�CuFeS2)������Ȼ���еij���������Դ��
��1��Stumm��Morgan����������ڿ������������IJ���Ӧ����20ͼ-1��ʾ��
�� a��Ӧ��ÿ����1molFeSO4ת�Ƶ��ӵ����ʵ���Ϊ___mol��
�� d��Ӧ�����ӷ���ʽΪ_______________��
��2����ϸ��ұͭʱ������ͭ���а��л������������߽�ȡ���ʣ���ԭ������20ͼ-2
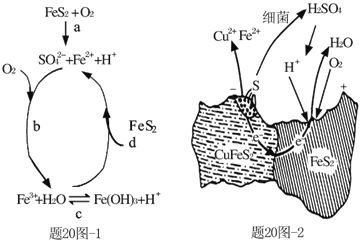
��ұ�������У�������Χ��Һ��pH___��ѡ���������������С��������������
����������������ĵ缫��ӦʽΪ___��
�������ʹ��ˣ����ĺ�ɾ���� |
��3��ú̿�е�����Ҫ�Ի�������ʽ���ڣ��������ѳ��������������ط�Ӧ�����±���������ط�Ӧ��ƽ�ⳣ���Ķ���ֵ���¶ȵĹ�ϵ����20ͼ��3��
��ط�Ӧ | ��Ӧ�� | ƽ�ⳣ��K |
FeS2(s) + H2(g) | ��H1 | K1 |
1/2 FeS2(s) + H2(g) | ��H2 | K2 |
FeS(s) + H2(g) | ��H3 | K3 |
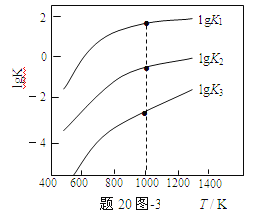
��������Ӧ�У���H1___0��ѡ�������������������
���������ѳ��ʿɲ�ȡ�Ĵ�ʩ��___����1������
��1000Kʱ��ƽ�ⳣ���Ķ���lgK1��lgK2��lgK3֮��Ĺ�ϵΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Լ�����������ӦΪ��2NO2(g)��O3(g) ![]() N2O5(g)��O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ����(����)
N2O5(g)��O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ����(����)
A | B | C | D |
|
|
|
|
�����¶ȣ�ƽ�ⳣ����С | 0��3 s�ڣ���Ӧ����Ϊ��v(NO2)��0��2 mol��L��1 | t1ʱ�����������ƽ�������ƶ� | ��ƽ��ʱ�����ı�x����xΪc(O2) |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ�������ҽҩ��������������Ҫ���ã���ʶ�����仯��������Ҫ���塣
��1����̬��ԭ���У�����ռ�ݵ�����ܼ�����Ϊ_____________��
��2���о������������������������δ�ɶԵ���ʱ���û�������д��ԡ��������ʿ�����¼�����ŷ۵���__________��
A��V2O5 B��Fe2O3 C��ZnO D��CrO2
��3����֪Cr3+��ˮ��Һ�еĴ�����ʽΪ[Cr(H2O)6��3+���ڲ�ͬ�����£��ɴ�CrCl3ˮ��Һ�л����ɫ������ɫ����ɫ�Ȳ�ͬ��ɫ��������ʵ��ʽ��ΪCrCl36H2O����ȡ����ɫ�����0.1mol����������AgNO3��Һ�������ˡ�ϴ�ӡ������28.7g��������û������еĻ�ѧ��������___________��д��������ɫ�����ĵ��뷽��ʽ��________��
��4�������£��Ȼ�����(CrO2Cl2)�ǰ���ɫҺ�壬����CCl4��CS2���л��ܼ����ܡ�
�ٹ����Ȼ���������______�����������������Ǽ����������ӣ��ж�������______��
�ڵȵ������Ǿ�����ͬ�ļ۵�������ԭ�����ķ��ӻ����ӡ�д��һ����CCl4���ӻ�Ϊ�ȵ�����������ӣ�_______���ѧʽ����д��CS2���ӵĵ���ʽ��____________��
��5��������(CrN)�ڳ�������������������Ӧ��ǰ�����侧��ṹ�������Ȼ�����ͬ��
�ٵ��������۵���Ȼ��Ƹߵ���Ҫԭ����______��
����Cr3+���ڽ���N3�C��________����
����֪Cr3+��N3�C�뾶�ֱ�Ϊapm��bpm����Cr3+��N3�C���ǽ��ܽӴ��ĸ���С��NA���������ӵ�������ֵ��������ܶ�Ϊ��gcm�C3����CrN��Ħ������Ϊ______�����ú�a��b��NA��������ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����![]()
![]() kJ��mol-1
kJ��mol-1
��![]()
![]() kJ��mol-1
kJ��mol-1
��![]()
![]() kJ��mol-1
kJ��mol-1
����˵����ȷ����
A.![]() ��ȼ����
��ȼ����![]() kJ��mol-1
kJ��mol-1
B.![]()
![]() kJ��mol-1
kJ��mol-1
C.�����ʵ�����![]() ��
��![]() ��ȫȼ�գ�
��ȫȼ�գ�![]() �ų�����������
�ų�����������
D.��������Һ�У�![]() ��
��![]() �����γ�ȼ�ϵ��
�����γ�ȼ�ϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ij2 L�ܱ������м���һ�����Ĺ���A������B��������ӦA(s)��2B(g)![]() D(g)��E(g)����H��Q kJ��mol��1����T��ʱ����Ӧ���е���ͬʱ���ø����ʵ����ʵ��������
D(g)��E(g)����H��Q kJ��mol��1����T��ʱ����Ӧ���е���ͬʱ���ø����ʵ����ʵ��������
������ʱ��(min) ���ʵ���(mol)���������� | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T��ʱ���÷�Ӧ��ƽ�ⳣ��K��________��
(2)30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬���ݱ��е������жϸı������������________(����ĸ���)��
a��ͨ��һ������B b������һ�����Ĺ���A c���ʵ���С��������� d�����߷�Ӧ��ϵ�¶� e��ͬʱ����0.2mol B��0.1mol D��0.1mol E
(3)д�����е������ˮ�еĵ��뷽��ʽ��
CH3COOH��____________NaHSO4��______ NaHCO3��_________H2CO3��_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ����ֱ�����ΰ��ϵĸ�����Һ�У��������£�
ʵ�� | ���� |
| ������Һ�������������������� |
�������������� | |
������Һ��ɫ | |
���в�������ɫ���� |
���з�����ȷ���ǣ� ��
A.��������������Ũ�����������
B.��������˵��δ������Ӧ
C.���з�Ӧ����Ԫ��ȫ����KCl��ʽ����
D.���в�������ɫ����ķ�Ӧ�ǣ�ClO��+ Cl��+ 2H+ = Cl2��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ���װ�ý������е�SO2��NOת��Ϊ(NH4)2SO4��������Ϊһ�������ĵ��ʡ������й�˵����ȷ����
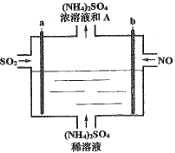
A.ÿ����lmol NO��������2mol A
B.a���Դ����������������ԭ��Ӧ
C.ͨ�������������Һ��pH����
D.�����Ͻ�SO2��NO�������2��5ͨ��װ�ÿɳ���ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������γɾ���ʱ��ᾧһ������ˮ���ڹ�ũҵ�����о�����Ҫ��;�����������Ӱ��������������﮵�ص�ԭ�ϵȡ�
��֪���ٲ�������������ˮ�����������Fe(SCN)63-+3C2O42-=Fe(C2O4)33-+6SCN-��
�ش��������⣺
��.��ͬѧ���ҩƷ���ָþ�����dz��ɫ����Ϊ���岻������������Ϊ���ֵ�����������Ϊ��֤�Լ��IJ��룬����ʵ����֤��ȡ�����ľ�����Ʒ����ϡ���ᣬ�μ�KSCN��Һ����Һ�����Ա仯���ɴ���Ϊ�����в�����+3�۵���������Ϊ_______�����ȷ������ȷ������������___________________________________��
��.��ͬѧΪ�ⶨ������������FeC2O4�qxH2O�еĽᾧˮ��������������װ�ã�
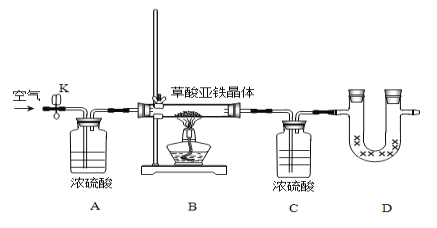
����ʵ��ǰ����Ҫ_____________________________��
�ڳ�ȡһ�������ľ��壬װ��ҩƷ����ʼʵ���������ʵ�鲽������Ϊ____________________���ظ�ʵ��ֱ��B�к��ء�
a.��ȼ�ƾ��ƣ����� b.Ϩ��ƾ��� c.�ر�K d.��K������ͨ����� e.��ȴ������ f.����
��.��ͬѧ�õζ��ķ���Ҳ���Բⶨ�������������нᾧˮ�ĺ�����ȡa�˲���������������ϡ���ᣬ�ٰ�������Һϡ�ͳ�500mL��ȡ��50mL������ƿ����������ε���δ֪Ũ�ȵ�����KMnO4��Һ����������Һ��ɫ��Ϊ�ػ�ɫ����������ð��������Һ��ɫͻ���dz��ɫ��ֹͣ�μӡ���������Һ�м����Թ�����KI��Һ�ͼ��ε�����Һ��Ȼ������c mol/L��Na2S2O3��Һ�����յ㡣����ʵ��ƽ������Na2S2O3��ҺVmL����2Na2S2O3+I2=Na2S4O6+2NaI��
��1��д������Һ�еμ�����KMnO4��Һ������Ӧ�����ӷ���ʽ_____________________
��2������������ϡ�Ͳ���������Һʱ���ձ��Ͳ������⣬������IJ���������__________
��3��x=_______________
��4����ʵ���е���KMnO4��Һ����,������xֵ___________(��ƫ��ƫС����Ӱ��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com