
【题目】用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
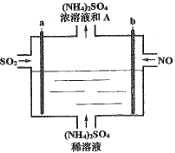
A.每处理lmol NO可以生成2mol A
B.a与电源负极相连,发生还原反应
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2∶5通入装置可彻底转化
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为__________(填元素符号)。Y的氢化物的分子空间构型是_______。其中心原子采取_____杂化,属__________(填“极性”或“非极性”)分子。
(2)E元素基态原子的电子排布式为_______________________________。
(3)XZ2分子中含有________个π键。
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是____________________________。
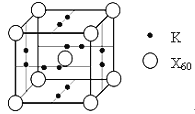
(5)X元素可形成X60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X60与钾原子个数比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向X溶液中滴加 | X溶液中一定含有 |
B | 向浓度均为0.05mol·L-1的 |
|
C | 向2mL浓度均为0.05mol·L-1的 |
|
D | 向 | 结合 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 反应过程的能量变化如图所示,请回答下列问题:
反应过程的能量变化如图所示,请回答下列问题:
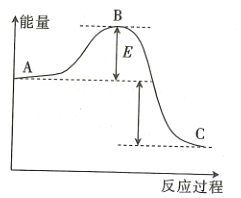
(1)该反应是______________(填“放热”或“吸热”)反应。
(2)用![]() 作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
(3)在体积为2L的恒容密闭容器中通入2mol![]() 和3mol
和3mol![]() 发生上述反应,10min内
发生上述反应,10min内![]() 的物质的量变化如下表:
的物质的量变化如下表:
反应时间(min) | 0 | 3 | 5 | 7 | 10 |
| 0 | 0.2 | 0.3 | 0.38 | 0.38 |
①升高温度,反应速率______________(填“增大”或“减小”)。
②上述反应在7min时_______________(填“达到”或“未达到”)平衡状态。
③![]() min内,用
min内,用![]() 表示该反应的反应速率为_______________mol·L-1·min-1。
表示该反应的反应速率为_______________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系表示正确的是 ()
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系表示正确的是 ()
A. 5v(NH3)=6v(O2)B. 5v(O2)=6v(H2O)
C. 2v(NH3)=2v(H2O)D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A→B、B→C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是

A. 两步反应均为吸热反应 B. 三种化合物中C最稳定
C. 加入催化剂会改变反应的焓变 D. 整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁元素是构成人体的必不可少的元素之一,缺铁会影响到人体的健康和发育,最大的影响是缺铁性贫血。此类病人需要服用补铁药品。

一个体重50 kg的健康人含铁2 g,这2g铁在人体中以Fe2+和Fe3+的形式存在。以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是________。
A.Fe B.Fe2+ C.Fe3+
(2)亚硝酸钠有毒,有传言说亚硝酸钠是致癌物质,但事实上亚硝酸钠并不是致癌物质,致癌的是亚硝酸钠在一定条件下生成的亚硝胺。工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有_______性。下列不能实现上述转化的物质是_______。
A.Cl2 B.O2 C.FeCl3 D.KMnO4(H+)
(3)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了________性和________性,则生成1分子NO转移电子数为________;56g Fe参加反应时,被还原的HNO3为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2O中含有氢原子数目为2NA
B.17 g NH3所含质子数为10NA
C.0.1 mol Cu(NO3)2中含有的离子数目为0.2NA
D.28 g N2体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物是重要的合金材料和催化剂。
(1)基态镍原子的价电子排布式为___,它核外有___种运动状态不同的电子。
(2)Ni2+可以形成多种配离子,比如[Ni(NH3)4]2+、[Ni(CN)4]2-等。CN-中碳原子的杂化方式为___,与CN-互为等电子体的一种分子是___。[Ni(NH3)4]2+中H-N-H键角比NH3分子中H-N-H键角___(填“大”、“小”或“相等”),原因是___。
(3)元素铜与镍的第二电离能分别为:I2(Cu)=1958kJ/mol、I2(Ni)=1753kJ/mol,铜的第二电离能更大的原因是___。
(4)NiO的晶体结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___。
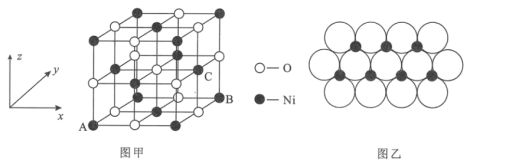
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数的值为NA,每平方米面积上分散的该晶体的质量为___g(用含a、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com