
【题目】4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系表示正确的是 ()
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系表示正确的是 ()
A. 5v(NH3)=6v(O2)B. 5v(O2)=6v(H2O)
C. 2v(NH3)=2v(H2O)D. 4v(O2)=5v(NO)
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
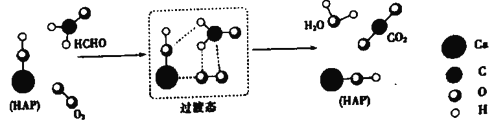
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]()
![]() kJ·mol-1
kJ·mol-1
②![]()
![]() kJ·mol-1
kJ·mol-1
③![]()
![]() kJ·mol-1
kJ·mol-1
下列说法正确的是
A.![]() 的燃烧热
的燃烧热![]() kJ·mol-1
kJ·mol-1
B.![]()
![]() kJ·mol-1
kJ·mol-1
C.等物质的量的![]() 和
和![]() 完全燃烧,
完全燃烧,![]() 放出的热量更多
放出的热量更多
D.在中性溶液中,![]() 和
和![]() 不能形成燃料电池
不能形成燃料电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验 | 现象 |
| ①中溶液变蓝且无其他明显现象 |
②中无明显现象 | |
③中溶液褪色 | |
④中产生黄绿色气体 |
下列分析正确的是( )
A.①中现象体现了浓盐酸的氧化性
B.②中现象说明未发生反应
C.③中反应后氯元素全部以KCl形式存在
D.④中产生黄绿色气体的反应是:ClO-+ Cl-+ 2H+ = Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 |
|
|
|
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 |
|
|
|
回答下列问题:
(1)pH相等的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液中,物质的量浓度最小的是____________(填化学式)。
溶液中,物质的量浓度最小的是____________(填化学式)。
(2)已知![]() 为正盐,依据表格数据,
为正盐,依据表格数据,![]() 的第二级电离平衡常数表达式
的第二级电离平衡常数表达式![]() ___________;25℃时,5.6mol·L-1
___________;25℃时,5.6mol·L-1![]() 溶液的pH=____________。
溶液的pH=____________。
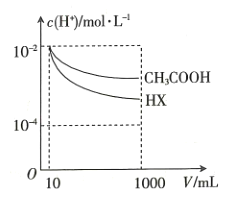
(3)向体积均为10mL、![]() 均为
均为![]() mol·L-1的
mol·L-1的![]() 溶液和一元酸
溶液和一元酸![]() 溶液中,分别加水稀释至1000mL,稀释过程中
溶液中,分别加水稀释至1000mL,稀释过程中![]() 的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)
的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)![]() 的电离平衡常数,理由是______________________________。
的电离平衡常数,理由是______________________________。
(4)常温下,将0.05mol·L-1的氨水逐滴加入10mL0.1mol·L-1![]() 溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
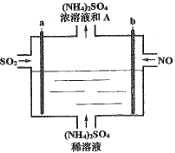
A.每处理lmol NO可以生成2mol A
B.a与电源负极相连,发生还原反应
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2∶5通入装置可彻底转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
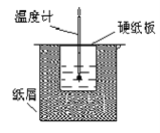
(1)从实验装置上看,图中伤缺少的一种玻璃仪器是_____________;
(2)烧杯间填满碎纸条的作用是____________________;
(3)若大烧杯上不盖硬纸板,求得的反应热数值__________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60 mL 0.50 mol·L-1HCl跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”)。
(6)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热数值____________(填“偏大”、“偏小”或“不变”)。
(7)量取溶液时,仰视读数。测得的中和热数值________(填“偏大”、“偏小”或“无影响”)
(8)实验过程中有液体洒在外面,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
(9)混合酸、碱溶液时,动作缓慢,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
(10)实验中能否用环形铁(铜)丝搅拌棒代替环形玻璃搅拌棒,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,酸性:HF>HCN,分别向1L1mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积的变化),溶液中的(X表示F或CN)随pH变化如图所示,下列说法正确的是
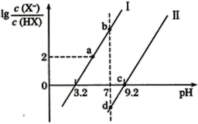
A.HF的电离常数Ka(HF)的数量级10-4
B.d点溶液中:c(Na+)=c(X-)>c(HX)
C.a到b点的过程中水的电离程度先变大后变小
D.b点溶液和d点溶液中c(Na+):b<d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法净化水过程如图所示。下列说法中错误的是

A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的![]() 、
、![]() 、Cl通过阴离子树脂后被除去
、Cl通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH![]() H2O
H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com