
ЎҫМвДҝЎҝ25ЎжКұЈ¬ИэЦЦЛбөДөзАлЖҪәвіЈКэИзПВұнЛщКҫЎЈ
»ҜС§КҪ |
|
|
|
ГыіЖ | ҙЧЛб | ҙОВИЛб | СЗБЧЛб |
өзАлЖҪәвіЈКэ |
|
|
|
»ШҙрПВБРОКМвЈә
(1)pHПаөИөД![]() ИЬТәЎў
ИЬТәЎў![]() ИЬТәЎў
ИЬТәЎў![]() ИЬТәЦРЈ¬ОпЦКөДБҝЕЁ¶ИЧоРЎөДКЗ____________ЈЁМо»ҜС§КҪЈ©ЎЈ
ИЬТәЦРЈ¬ОпЦКөДБҝЕЁ¶ИЧоРЎөДКЗ____________ЈЁМо»ҜС§КҪЈ©ЎЈ
(2)ТСЦӘ![]() ОӘХэСОЈ¬ТАҫЭұнёсКэҫЭЈ¬
ОӘХэСОЈ¬ТАҫЭұнёсКэҫЭЈ¬![]() өДөЪ¶юј¶өзАлЖҪәвіЈКэұнҙпКҪ
өДөЪ¶юј¶өзАлЖҪәвіЈКэұнҙпКҪ![]() ___________Ј»25ЎжКұЈ¬5.6molЎӨL-1
___________Ј»25ЎжКұЈ¬5.6molЎӨL-1![]() ИЬТәөДpH=____________ЎЈ
ИЬТәөДpH=____________ЎЈ
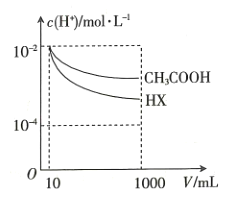
(3)ПтМе»эҫщОӘ10mLЎў![]() ҫщОӘ
ҫщОӘ![]() molЎӨL-1өД
molЎӨL-1өД![]() ИЬТәәНТ»ФӘЛб
ИЬТәәНТ»ФӘЛб![]() ИЬТәЦРЈ¬·ЦұрјУЛ®ПЎКНЦБ1000mLЈ¬ПЎКН№эіМЦР
ИЬТәЦРЈ¬·ЦұрјУЛ®ПЎКНЦБ1000mLЈ¬ПЎКН№эіМЦР![]() өДұд»ҜИзНјЛщКҫЈ¬ФтHXөДөзАлЖҪәвіЈКэ____________ЈЁМоЎ°ҙуУЪЎұЎ°РЎУЪЎұ»тЎ°өИУЪЎұЈ©
өДұд»ҜИзНјЛщКҫЈ¬ФтHXөДөзАлЖҪәвіЈКэ____________ЈЁМоЎ°ҙуУЪЎұЎ°РЎУЪЎұ»тЎ°өИУЪЎұЈ©![]() өДөзАлЖҪәвіЈКэЈ¬АнУЙКЗ______________________________ЎЈ
өДөзАлЖҪәвіЈКэЈ¬АнУЙКЗ______________________________ЎЈ
(4)іЈОВПВЈ¬Ҫ«0.05molЎӨL-1өД°ұЛ®ЦрөОјУИл10mL0.1molЎӨL-1![]() ИЬТәЦРЦБИЬТәПФЦРРФЈ¬ҙЛКұИЬТәЦРёчАлЧУЕЁ¶ИҙуРЎ№ШПөОӘ_________________ЎЈ
ИЬТәЦРЦБИЬТәПФЦРРФЈ¬ҙЛКұИЬТәЦРёчАлЧУЕЁ¶ИҙуРЎ№ШПөОӘ_________________ЎЈ
Ўҫҙр°ёЎҝ![]()
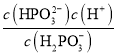 10 ҙуУЪ
10 ҙуУЪ ![]() ПаН¬өД
ПаН¬өД![]() ИЬТәәН
ИЬТәәН![]() ИЬТәПЎКНПаН¬өДұ¶КэЈ¬
ИЬТәПЎКНПаН¬өДұ¶КэЈ¬![]() ИЬТәөД
ИЬТәөД![]() ұд»Ҝёьҙу
ұд»Ҝёьҙу ![]()
ЎҫҪвОцЎҝ
(1)ЛбөДөзАлЖҪәвіЈКэФҪРЎЈ¬ЛбРФФҪИхЈ¬ФтПаН¬pHЦөКұЈ¬ЛбөДЕЁ¶ИФҪҙуЈ¬ёщҫЭұнёсКэҫЭҝЙЦӘKa1(H3PO3) >Ka(CHCOOH)> Ka(HClO)>Ј¬ЛщТФpHПаөИөДИэЦЦИЬТәH3PO3өДЕЁ¶ИЧоРЎЈ»
(2)Na2HPO3ОӘХэСОЈ¬ФтH3PO3ОӘ¶юФӘИхЛбЈ¬ЖдөЪ¶юј¶өзАл·ҪіМКҪОӘH2PO3-![]() HPO32-+H+Ј¬ЖдөзАлЖҪәвіЈКэұнҙпКҪОӘ
HPO32-+H+Ј¬ЖдөзАлЖҪәвіЈКэұнҙпКҪОӘ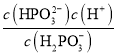 Ј»Na2HPO3ИЬТәЦРҙжФЪЧЕЛ®ҪвЖҪәвHPO32-+H2O
Ј»Na2HPO3ИЬТәЦРҙжФЪЧЕЛ®ҪвЖҪәвHPO32-+H2O![]() H2PO3-+OH-Ј¬Йиc(OH-)=aЈ¬ФтЖдЛ®ҪвЖҪәвіЈКэОӘ
H2PO3-+OH-Ј¬Йиc(OH-)=aЈ¬ФтЖдЛ®ҪвЖҪәвіЈКэОӘ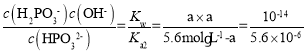 Ј¬ҪвөГaФјОӘ10-4mol/LЈ¬ФтИЬТәЦРc(H+)=10-10mol/LЈ¬pH=10Ј»
Ј¬ҪвөГaФјОӘ10-4mol/LЈ¬ФтИЬТәЦРc(H+)=10-10mol/LЈ¬pH=10Ј»
(3)ЛбРФФҪИхПЎКНКұpHјҙc(H+)ұд»ҜФҪВэЈ¬ҫЭНјc(H+)ПаН¬өДҙЧЛбИЬТәәНHXИЬТәПЎКНПаН¬өДұ¶КэЈ¬HXИЬТәөДc(H+)ұд»ҜёьҙуЈ¬ЛщТФHXөДөзАлЖҪәвіЈКэҙуУЪҙЧЛбөДөзАлЖҪәвіЈКэЈ»
(4)ИЬТәЦРҙжФЪөзәЙКШәгЈәc(NH4+)+ c(H+)=c(CH3COO-)+ c(OH-)Ј¬¶шИЬТәіКЦРРФЛщТФc(H+)=c(OH-)Ј¬ЛщТФc(NH4+)=c(CH3COO-)Ј¬Л®өДөзАліМ¶ИҪПРЎЈ¬ФтАлЧУЕЁ¶ИҙуРЎЛіРтОӘc(NH4+)=c(CH3COO-)Јҫc(H+)=c(OH-)ЎЈ


 ГыРЈБ·ҝјҫнЖЪД©іеҙМҫнПөБРҙр°ё
ГыРЈБ·ҝјҫнЖЪД©іеҙМҫнПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҝЙДж·ҙУҰ:A(g)+B(g) ![]() C(s)+2D(g)өДҰӨH>0,ПВНјЛщКҫОӘХэДж·ҙУҰЛЩВК(v)УлКұјд(t)өД№ШПө,Из№ыФЪt1КұҝМёДұдТФПВМхјю:ўЩјУИлA;ўЪјУИлҙЯ»ҜјБ;ўЫјУС№;ўЬЙэОВ;ўЭТЖЧЯC,·ыәПНјКҫөДМхјюКЗ(ЎЎЎЎ)ЎЈ
C(s)+2D(g)өДҰӨH>0,ПВНјЛщКҫОӘХэДж·ҙУҰЛЩВК(v)УлКұјд(t)өД№ШПө,Из№ыФЪt1КұҝМёДұдТФПВМхјю:ўЩјУИлA;ўЪјУИлҙЯ»ҜјБ;ўЫјУС№;ўЬЙэОВ;ўЭТЖЧЯC,·ыәПНјКҫөДМхјюКЗ(ЎЎЎЎ)ЎЈ
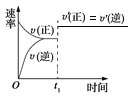
A. ўЪўЫB. ўЩўЪC. ўЫўЬD. ўЬўЭ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР№ШУЪҪәМеөДЛө·ЁХэИ·өДКЗЈЁ Ј©
A. ТАҫЭ¶Ўҙп¶ыР§УҰҝЙҪ«·ЦЙўПө·ЦОӘИЬТәЎўҪәМеУлЧЗТә
B. ПтОЫЛ®ЦРН¶·ЕГч·ҜЈ¬ЙъіЙДЬДэҫЫРьёЎОпөДҪәМеЈәAl3+Ј«3H2O![]() Al(OH)3(ҪәМе)Ј«3H+
Al(OH)3(ҪәМе)Ј«3H+
C. Na+ЎўK+ЎўSO42-ЎўBr-ДЬФЪFe(OH)3ҪәМеЦРҙуБҝ№Іҙж
D. ·РЛ®ЦРөОјУККБҝұҘәНFeCl3ИЬТәЈ¬РОіЙҙшөзөДҪәМеЈ¬өјөзДЬБҰФцЗҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР»ҜС§·ҙУҰЦРЈ¬І»КЗСх»Ҝ»№Фӯ·ҙУҰөДКЗЈЁ Ј©
A.3NO2 + H2O = 2HNO3 + NOB.2 H2+O2![]() 2H2O
2H2O
C.Cl2Ј«H2O=HClOЈ«HClD.CuCl2Ј«Ba(OH)2=Cu(OH)2Ј«BaCl2
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝёЯМъЛбјШЈЁK2FeO4Ј©КЗТ»ЦЦРВРНЎўёЯР§Ўў¶а№ҰДЬВМЙ«Л®ҙҰАнјБЎЈ№ӨТөЙПЦЖұёёЯМъЛбјШТФј°ёЯМъЛбјШҙҰАнОЫЛ®өДІҝ·ЦБчіМИзПВЈә
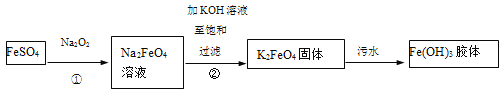
ТФПВЛө·ЁІ»ХэИ·өДКЗ
A.ўЩЦРТ»¶Ё·ўЙъБЛСх»Ҝ»№Фӯ·ҙУҰ
B.ОЫЛ®ҙҰАнЦРІъЙъFe(OH)3ҪәМеЈ¬К№РьёЎОпҫЫіБЈ¬АыУГБЛҪәМеҫЯУРҪПЗҝОьёҪДЬБҰөДМШөг
C.БнТ»ЦЦФЪјоРФМхјюПВЦЖұёK2FeO4өД·ҙУҰҝЙДЬКЗЈә2Fe(OH)3+3ClOЈӯ=2FeO42-+3ClЈӯ+4H+ +H2O
D.K2FeO4»№ҝЙТФУГУЪҙҰАн·ПЛ®Ј¬АэИзҝЙТФ°С·ПЛ®ЦРөДCNЈӯЧӘ»ҜОӘБҪЦЦОЮ¶ҫЖшМеЈ¬·ҙУҰ№эіМЦРЈ¬CNЈӯЧц»№ФӯјБЈ¬ұ»K2FeO4Сх»Ҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ4NH3+5O2![]() 4NO+6H2OЈ¬Иф·ҙУҰЛЩВК·ЦұрУГvЈЁNH3Ј©ЎўvЈЁO2Ј©ЎўvЈЁNOЈ©ЎўvЈЁH2OЈ©ұнКҫЈ¬ФтПВБР№ШПөұнКҫХэИ·өДКЗ ЈЁЈ©
4NO+6H2OЈ¬Иф·ҙУҰЛЩВК·ЦұрУГvЈЁNH3Ј©ЎўvЈЁO2Ј©ЎўvЈЁNOЈ©ЎўvЈЁH2OЈ©ұнКҫЈ¬ФтПВБР№ШПөұнКҫХэИ·өДКЗ ЈЁЈ©
A. 5vЈЁNH3Ј©=6vЈЁO2Ј©B. 5vЈЁO2Ј©=6vЈЁH2OЈ©
C. 2vЈЁNH3Ј©=2vЈЁH2OЈ©D. 4vЈЁO2Ј©=5vЈЁNOЈ©
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР№ШУЪВИЛ®өДЛө·ЁХэИ·өДКЗЈЁЎЎЎЎЈ©
A. РВЦЖВИЛ®ә¬УРCl2ЎўHClЎўHClOЎўH2O·ЦЧУ
B. ЧПЙ«КҜИпКФјБөОИлРВЦЖВИЛ®ЦРЈ¬ИЬТәПИұдәмәуұдОЮЙ«
C. ВИЛ®әНТәВИ¶јДЬК№ёЙФпөДУРЙ«ІјМхНКЙ«
D. РВЦЖВИЛ®өДpHЦөТӘұИҫГЦГВИЛ®өДpHЦөРЎ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝКөСй·ўПЦЈ¬298 KКұЈ¬ФЪВИ»ҜМъЛбРФИЬТәЦРјУЙЩБҝРҝБЈәуЈ¬Fe3Ј«Бўјҙұ»»№ФӯіЙFe2Ј«ЎЈДіПДБоУӘРЛИӨРЎЧйёщҫЭёГКөСйКВКөЙијЖБЛИзНјЛщКҫФӯөзіШЧ°ЦГЎЈПВБРУР№ШЛө·ЁХэИ·өДКЗ
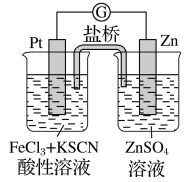
A. ёГФӯөзіШөДХэј«·ҙУҰКЗЈәZnЈӯ2eЈӯ=Zn2Ј«
B. ЧуЙХұӯЦРИЬТәөДәмЙ«ЦрҪҘНКИҘ
C. ёГөзіШІ¬өзј«ЙПБўјҙУРЖшЕЭіцПЦ
D. ёГөзіШЧЬ·ҙУҰОӘЈә3ZnЈ«2Fe3Ј«=2FeЈ«3Zn2Ј«
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРКөСйІЩЧчДЬҙпөҪКөСйДҝөДөДКЗ
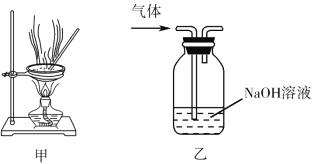
A. УГҫӯЛ®КӘИуөДpHКФЦҪІвБҝИЬТәөДpH
B. Ҫ«4.0 g NaOH№ММеЦГУЪ100 mLИЭБҝЖҝЦРЈ¬јУЛ®ЦБҝМ¶ИЈ¬ЕдЦЖ1.000 molЎӨL1NaOHИЬТә
C. УГЧ°ЦГјЧХфёЙAlCl3ИЬТәЦЖОЮЛ®AlCl3№ММе
D. УГЧ°ЦГТТіэИҘКөСйКТЛщЦЖТТП©ЦРөДЙЩБҝSO2
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com