
【题目】下列化学反应中,不是氧化还原反应的是( )
A.3NO2 + H2O = 2HNO3 + NOB.2 H2+O2![]() 2H2O
2H2O
C.Cl2+H2O=HClO+HClD.CuCl2+Ba(OH)2=Cu(OH)2+BaCl2
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】有一瓶无色澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、H+、Cu2+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有___________,肯定不存在的离子有__________________。
(2)写出实验②中的离子反应方程式________________________。
(3)不能确定是否存在的离子有__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]()
![]() kJ·mol-1
kJ·mol-1
②![]()
![]() kJ·mol-1
kJ·mol-1
③![]()
![]() kJ·mol-1
kJ·mol-1
下列说法正确的是
A.![]() 的燃烧热
的燃烧热![]() kJ·mol-1
kJ·mol-1
B.![]()
![]() kJ·mol-1
kJ·mol-1
C.等物质的量的![]() 和
和![]() 完全燃烧,
完全燃烧,![]() 放出的热量更多
放出的热量更多
D.在中性溶液中,![]() 和
和![]() 不能形成燃料电池
不能形成燃料电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)在—定温度和压强下,CO(g)+2H2(g)![]() CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
(2)判断该反应达到平衡状态的依据是________(填字母序号)。
a.混合气体的密度不变 b.混合气体的平均相对分子质量不变 c.2v逆(H2)=v正(CO) d.容器内CO、H2、CH3OH的浓度之比为1∶2∶1 e.CH3OH、CO、H2的浓度都不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验 | 现象 |
| ①中溶液变蓝且无其他明显现象 |
②中无明显现象 | |
③中溶液褪色 | |
④中产生黄绿色气体 |
下列分析正确的是( )
A.①中现象体现了浓盐酸的氧化性
B.②中现象说明未发生反应
C.③中反应后氯元素全部以KCl形式存在
D.④中产生黄绿色气体的反应是:ClO-+ Cl-+ 2H+ = Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 |
|
|
|
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 |
|
|
|
回答下列问题:
(1)pH相等的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液中,物质的量浓度最小的是____________(填化学式)。
溶液中,物质的量浓度最小的是____________(填化学式)。
(2)已知![]() 为正盐,依据表格数据,
为正盐,依据表格数据,![]() 的第二级电离平衡常数表达式
的第二级电离平衡常数表达式![]() ___________;25℃时,5.6mol·L-1
___________;25℃时,5.6mol·L-1![]() 溶液的pH=____________。
溶液的pH=____________。
(3)向体积均为10mL、![]() 均为
均为![]() mol·L-1的
mol·L-1的![]() 溶液和一元酸
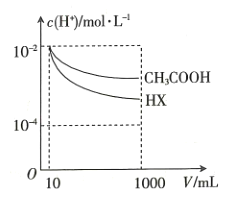
溶液和一元酸![]() 溶液中,分别加水稀释至1000mL,稀释过程中
溶液中,分别加水稀释至1000mL,稀释过程中![]() 的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)
的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)![]() 的电离平衡常数,理由是______________________________。
的电离平衡常数,理由是______________________________。
(4)常温下,将0.05mol·L-1的氨水逐滴加入10mL0.1mol·L-1![]() 溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
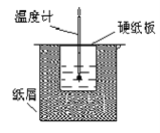
(1)从实验装置上看,图中伤缺少的一种玻璃仪器是_____________;
(2)烧杯间填满碎纸条的作用是____________________;
(3)若大烧杯上不盖硬纸板,求得的反应热数值__________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60 mL 0.50 mol·L-1HCl跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”)。
(6)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热数值____________(填“偏大”、“偏小”或“不变”)。
(7)量取溶液时,仰视读数。测得的中和热数值________(填“偏大”、“偏小”或“无影响”)
(8)实验过程中有液体洒在外面,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
(9)混合酸、碱溶液时,动作缓慢,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
(10)实验中能否用环形铁(铜)丝搅拌棒代替环形玻璃搅拌棒,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com