
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)在—定温度和压强下,CO(g)+2H2(g)![]() CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
(2)判断该反应达到平衡状态的依据是________(填字母序号)。
a.混合气体的密度不变 b.混合气体的平均相对分子质量不变 c.2v逆(H2)=v正(CO) d.容器内CO、H2、CH3OH的浓度之比为1∶2∶1 e.CH3OH、CO、H2的浓度都不再发生变化
【答案】![]() 正向移动 增大 be
正向移动 增大 be
【解析】
(1)起始时CO为10a mol,转化率为60%,所以反应的CO为6a mol,用三段式求平衡常数:
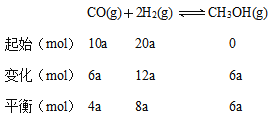
容器体积为2L,所以平衡时CO、H2、CH3OH的浓度分别为2a mol/L、4a mol/L、3a mol/L,则则该反应的平衡常数为![]() L2/mol2。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),CO、H2、CH3OH的物质的量分别为14a mol、28a mol、16a mol,浓度为7a mol/L、14a mol/L、8a mol/L,计算此时的
L2/mol2。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),CO、H2、CH3OH的物质的量分别为14a mol、28a mol、16a mol,浓度为7a mol/L、14a mol/L、8a mol/L,计算此时的![]() <
<![]() ,所以平衡正向移动;由于加入了CO,而容器体积不变,所以与原平衡相比,CO的物质的量浓度增大了;故答案为:
,所以平衡正向移动;由于加入了CO,而容器体积不变,所以与原平衡相比,CO的物质的量浓度增大了;故答案为:![]() ,正向移动,增大;
,正向移动,增大;
(2)a.混合气体的密度等于混合气的总质量除以容器的体积,由于反应物和生成物都是气体,根据质量守恒,混合气的总质量是不变的,容器体积一定,所以混合气的密度一直不变,所以密度不变不能说明该反应达到平衡状态;
b.混合气体的平均相对分子质量等于总质量除以总物质的量,总质量是不变的,但总物质的量在未平衡前是减小的,故当混合气体的平均相对分子质量不再变化时,反应达到了平衡状态;
c.用H2和CO表示的正逆反应速率之比等于化学方程式的化学计量数之比时,可以说明反应达到平衡状态,应为v逆(H2)=2v正(CO);
d.容器内CO、H2、CH3OH的浓度之比等于方程式的化学计量数之比和是否平衡无关,故容器内CO、H2、CH3OH的浓度之比为1∶2∶1不能说明反应达到平衡;
e.各物质的浓度不再变化可以说明反应达到平衡状态,故当CH3OH、CO、H2的浓度都不再发生变化可以说明反应达到了平衡状态;
故选be。


科目:高中化学 来源: 题型:
【题目】(1)已知常温时,0.1 mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=__,醋酸的电离平衡常数K=__。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
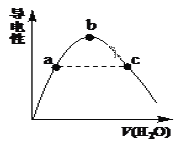
① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-) __c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8 | Ka1=4.3 | Ka=3.0 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱铁矿(主要成分为FeCO3,还含有少量Al2O3、SiO2等杂质)为原料,在实验室中制备FeCl36H2O晶体的流程如图所示,下列说法不正确的是( )
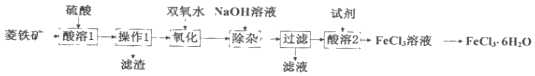
A.“操作1”需要用到的玻璃仪器有烧杯、玻璃棒、漏斗
B.“除杂”时,为了分离Fe3+和Al3+,应加入过量的NaOH溶液
C.“酸溶1”与“酸溶2”所加的试剂相同
D.在坩埚中对FeCl3溶液进行蒸发结晶可得FeCl36H2O晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法正确的是( )
A. 依据丁达尔效应可将分散系分为溶液、胶体与浊液
B. 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C. Na+、K+、SO42-、Br-能在Fe(OH)3胶体中大量共存
D. 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (如图)是一种重要的材料中间体,下列有关化合物
(如图)是一种重要的材料中间体,下列有关化合物![]() 的说法中正确的是
的说法中正确的是
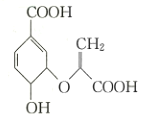
A.分子中含有三种官能团
B.可与乙醇、乙酸反应
C.所有碳原子一定处于同一平面
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,不是氧化还原反应的是( )
A.3NO2 + H2O = 2HNO3 + NOB.2 H2+O2![]() 2H2O
2H2O
C.Cl2+H2O=HClO+HClD.CuCl2+Ba(OH)2=Cu(OH)2+BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
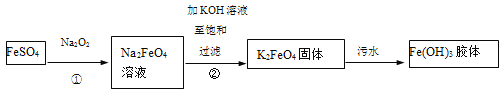
以下说法不正确的是
A.①中一定发生了氧化还原反应
B.污水处理中产生Fe(OH)3胶体,使悬浮物聚沉,利用了胶体具有较强吸附能力的特点
C.另一种在碱性条件下制备K2FeO4的反应可能是:2Fe(OH)3+3ClO-=2FeO42-+3Cl-+4H+ +H2O
D.K2FeO4还可以用于处理废水,例如可以把废水中的CN-转化为两种无毒气体,反应过程中,CN-做还原剂,被K2FeO4氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的说法正确的是( )
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C. 氯水和液氯都能使干燥的有色布条褪色
D. 新制氯水的pH值要比久置氯水的pH值小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是国际上公认的对环境无二次污染的消毒杀菌剂。它常温下为气体,易溶于水,受热易分解。甲醇法制制备二氧化氯的工艺如图:
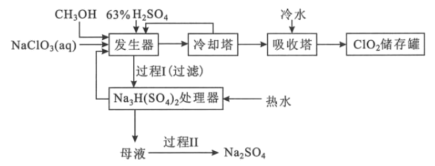
回答下列问题:
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有___性。
(2)加入“发生器”的浓硫酸先稀释为63%H2SO4,冷却后加入反应器的原因是___。实际操作中再“发生器”中加入适量NaCl以加快反应速率,若NaCl过量会发生成污染环境的一种气体的分子式为___。
(3)若1molCH3OH反应时转移6mole-,则“发生器”中发生反应的主要化学方程式为___。
(4)Na2SO4·10H2O和Na2SO4的溶解度曲线如图所示,则“过程Ⅱ”的操作是:加热浓缩至有大量晶体析出、___、经干燥得Na2SO4固体。
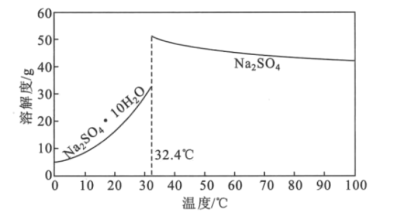
(5)采用惰性电极为阳极,通过电解亚氯酸钠溶液的方法也可以制备二氧化氯,其阳极的电极反应式为___。
(6)与甲醇法制备二氧化氯相比,电解法的优点是___(写出2点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com