
【题目】以菱铁矿(主要成分为FeCO3,还含有少量Al2O3、SiO2等杂质)为原料,在实验室中制备FeCl36H2O晶体的流程如图所示,下列说法不正确的是( )
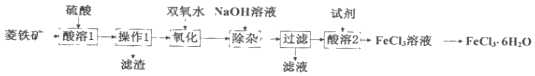
A.“操作1”需要用到的玻璃仪器有烧杯、玻璃棒、漏斗
B.“除杂”时,为了分离Fe3+和Al3+,应加入过量的NaOH溶液
C.“酸溶1”与“酸溶2”所加的试剂相同
D.在坩埚中对FeCl3溶液进行蒸发结晶可得FeCl36H2O晶体
【答案】CD
【解析】
以菱铁矿(主要成分为FeCO3,含有Al2O3、SiO2)为原料,加入稀硫酸酸溶过滤得到滤液为硫酸铝、硫酸亚铁溶液,滤渣为SiO2,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入过量氢氧化钠溶液沉淀铁离子,过滤得到氢氧化铁,滤液为偏铝酸钠和氢氧化钠的混合溶液,向过滤后所得固体,用水洗涤固体2﹣3次,加入稀盐酸使固体完全溶解,在氯化氢氛围内蒸发浓缩、冷却结晶,过滤,低温干燥,得到FeCl36H2O,以此解答该题。
A、操作1为过滤,用到的玻璃仪器有烧杯、玻璃棒、漏斗,故A正确;
B、加入过量氢氧化钠,可生成氢氧化铁、偏铝酸钠,以达到分离的目的,故B正确;
C、酸溶1加入硫酸,酸溶2加入盐酸,试剂不同,故C错误;
D、氯化铁易水解,一般在氯化氢氛围内蒸发浓缩、冷却结晶,过滤,低温干燥,得到FeCl36H2O,故D错误;
答案选CD。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将硫酸亚铁装入下图所示的装置a中,打开K1和K2缓缓通入N2加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是
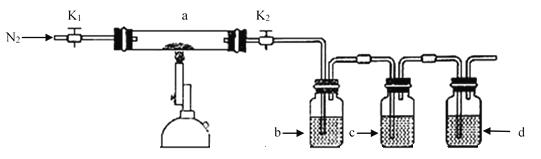
A.分解的气体产物中有SO3、SO2应该先检验SO3
B.装置b中的试剂为Ba(NO3)2溶液,反应后有白色沉淀生成,证明分解产物中有SO3气体
C.装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2
D.装置d之后需要增加尾气处理装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示2Na+2H2O═2NaOH+H2↑中的相关微粒,其中正确的是( )
A.H2O的电子式:![]()
B.中子数为10的氧原子:![]() O
O
C.Na+的结构示意图:![]()
D.NaOH的电离方程式:NaOH═Na++O2﹣+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )
2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )

A. 催化剂失效 B. 减小生成物的浓度
C. 降低体系温度 D. 增大容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO在工农业生产中有着重要的应用。
(1)CO是制备很多有机物(如甲醇、乙醇、甲醚等)的原料,现用CO与H2合成甲醇,反应如下:CO(g)+2H2(g)= CH3OH(g) △H=-99kJmol–1。
①已知断裂1molCO(g)中的化学键消耗的能量为1072kJ,断裂1molH2(g)中的化学键消耗的能量为436kJ,则形成1molCH3OH(g)中化学键释放的能量为_____。
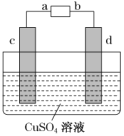
②用CH3OH 燃料电池电解精炼粗铜,装置如图所示。当消耗1mol甲醇时,d极质量增加了160g,则甲醇应加入____(填“a”或“b”)极,该电池的能量转化率为________(保留3位有效数字)。
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂。Ni的羰化反应为Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的![]() 倍。则:
倍。则:
①0~10min内平均反应速率v(Ni)=________gmin–1。
②研究表明正反应速率v正=k正x4(CO),逆反应速率v逆 =k逆x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),则T0温度下,![]() =_____。
=_____。
③当温度升高时k正_______k逆(填“大于”“小于”或“等于”),此时CO的转化率___________(填“变大”“变小”或“不变”)。
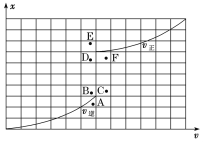
④T1温度下测得一定的实验数据,计算得到v正~x(CO)和v逆~x[Ni(CO)4]的关系可用如图进行表示。当降低温度时,反应重新达到平衡,相应的点分别为______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)在—定温度和压强下,CO(g)+2H2(g)![]() CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
(2)判断该反应达到平衡状态的依据是________(填字母序号)。
a.混合气体的密度不变 b.混合气体的平均相对分子质量不变 c.2v逆(H2)=v正(CO) d.容器内CO、H2、CH3OH的浓度之比为1∶2∶1 e.CH3OH、CO、H2的浓度都不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol) P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2![]() P4O6
P4O6
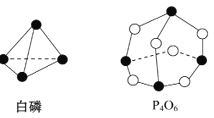
A. 放出1 638 kJ热量
B. 吸收1 638 kJ热量
C. 放出126 kJ热量
D. 吸收126 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com