
����Ŀ��CO�ڹ�ũҵ������������Ҫ��Ӧ�á�
��1��CO���Ʊ��ܶ��л����״����Ҵ������ѵȣ���ԭ�ϣ�����CO��H2�ϳɼ״�����Ӧ���£�CO(g)+2H2(g)= CH3OH(g) ��H=-99kJmol�C1��
����֪����1molCO(g)�еĻ�ѧ�����ĵ�����Ϊ1072kJ������1molH2(g)�еĻ�ѧ�����ĵ�����Ϊ436kJ�����γ�1molCH3OH(g)�л�ѧ���ͷŵ�����Ϊ_____��
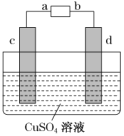
����CH3OH ȼ�ϵ�ص�⾫����ͭ��װ����ͼ��ʾ��������1mol�״�ʱ��d������������160g����״�Ӧ����____������a������b���������õ�ص�����ת����Ϊ________������3λ��Ч���֣���
��2��CO��Ni�����ʻ���Ӧ�γɵ���������Ϊ��ϩ����Ӧ�Ĵ�����Ni���ʻ���ӦΪNi(s)+4CO(g)![]() Ni(CO)4(g) ��H<0��T0�¶��£���������Ni�ۺ�3.7molCO���뵽�����ܱ������У�10minʱ��Ӧ�ﵽƽ�⣬�����ϵ��ѹǿΪԭ����
Ni(CO)4(g) ��H<0��T0�¶��£���������Ni�ۺ�3.7molCO���뵽�����ܱ������У�10minʱ��Ӧ�ﵽƽ�⣬�����ϵ��ѹǿΪԭ����![]() ������
������
��0��10min��ƽ����Ӧ����v(Ni)=________gmin�C1��
���о���������Ӧ����v��=k��x4(CO)���淴Ӧ����v�� =k��x[Ni(CO)4]��k����k���ֱ��ʾ����Ӧ���淴Ӧ�����ʳ�����xΪ���ʵ�������������T0�¶��£�![]() =_____��
=_____��
�۵��¶�����ʱk��_______k����������������С��������������������ʱCO��ת����___________���������������С����������������
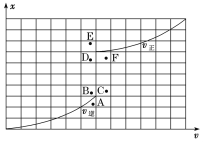
��T1�¶��²��һ����ʵ�����ݣ�����õ�v����x(CO)��v����x[Ni(CO)4]�Ĺ�ϵ������ͼ���б�ʾ���������¶�ʱ����Ӧ���´ﵽƽ�⣬��Ӧ�ĵ�ֱ�Ϊ______��______��
���𰸡�2043kJ b 83.3% 5.31 9��103����9000�� С�� ��С D B
��������
��1���ڱ���Ϊԭ��غ͵��صļ�������Ŀ��ˡ����ݵ��ԭ����d�缫�������ӣ�˵��������Cu2++2e-=Cu�ķ�Ӧ���ݴ˿��ж�ԭ��ص�������������������Cu���������������ת�Ƶĵ��������ݴ˿������ص�����ת���ʡ�
��1�������æ�H=�ƻ��ɼ����յ�������-�γ��¼��ͷŵ������������γ�1molCH3OH(g)�л�ѧ���ͷŵ�����Ϊx����![]() ��x=2043kJ����Ϊ��2043kJ��
��x=2043kJ������2043kJ��
��d����������160g��˵��d��Ϊ���������Դ�ĸ�����������b��Ϊȼ�ϵ�صĸ�������ȼ�ϴӸ������룬���Լ״�Ӧ����b����d����������160g������CuΪ2.5mol��ת�Ƶ���Ϊ![]() ��������1mol�״�����CH3OH��6e-�����Ե�ص�����ת����=
��������1mol�״�����CH3OH��6e-�����Ե�ص�����ת����=![]() ����Ϊ��b��83.3%��
������b��83.3%��
��2����ƽ��ʱNi(CO)4�����ʵ���Ϊx�����������г���Ӧ������ʽ��
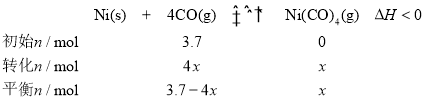
�¶�һ���������ܱ�������Vһ��������T��V��ͬʱ��![]() ������
������![]() ����
����![]() ��x=0.9��
��x=0.9��
��0��10min�ڷ�Ӧ����NiΪ0.9mol��������Ϊ53.1g������0��10min��ƽ����Ӧ����v(Ni)=![]() ����Ϊ��5.31��
������5.31��
�������Ϸ�����֪��T0�¶���ƽ��ʱn(CO)=0.1mol��n[Ni(CO)4]=0.9mol�����������ʵ���n��=1mol����x(CO)=0.1��x[Ni(CO)4]=0.9��ƽ��ʱv��=v������k��x4(CO)=k��x[Ni(CO)4]��![]() ����Ϊ��9��103����9000����
������9��103����9000����
�����ڷ�Ӧ���ȣ����¶�����ʱƽ�������ƶ������¶����߶��淴Ӧ���ʳ���Ӱ�������k����k��������ƽ�������ƶ�������CO��ת���ʱ�С����Ϊ��������С��
�����ڷ�Ӧ���ȣ��¶Ƚ��ͣ�ƽ�������ƶ�������v����v������С��x(CO)��С��x[Ni(CO)4]�������Է�Ӧ���´ﵽƽ����Ӧ�ĵ�ֱ�ΪD��B����Ϊ��D��B��


 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������������������ȷ���ǣ� ��
A.���³�ѹ�£�11.2L����������ԭ����ΪNA
B.1.8gNH4+�����к��еĵ�����ΪNA
C.���³�ѹ�£�48gO3���е���ԭ����ΪNA
D.5.6g������������������ַ�Ӧʱʧȥ�ĵ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ��ת����ϵ���ش��������⣺
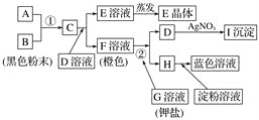
(1)д����Ӧ�ٵ����ӷ���ʽ��______________________________________________��д����Ӧ�ڵ����ӷ���ʽ��______________________��
(2)�Ƴ��������ʵĻ�ѧʽ��E____________��I______________��
(3)������ת�������У�B��C��F��H����������������ǿ��˳��Ϊ______________________(д��ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ�ɷ�ΪFeCO3������������Al2O3��SiO2�����ʣ�Ϊԭ�ϣ���ʵ�������Ʊ�FeCl36H2O�����������ͼ��ʾ������˵������ȷ���ǣ�������
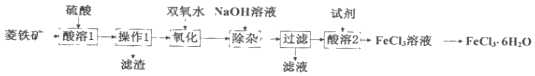
A.������1����Ҫ�õ��IJ����������ձ�����������©��
B.��������ʱ��Ϊ�˷���Fe3+��Al3+��Ӧ���������NaOH��Һ
C.������1����������2�����ӵ��Լ���ͬ
D.�������ж�FeCl3��Һ���������ᾧ�ɵ�FeCl36H2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵؿ��к������Ľ���Ԫ�أ��䵥�ʺͻ�����㷺Ӧ�����ճ������С�������пհף�
��1����Ԫ�������ڱ��е�λ��Ϊ_____
��2�������õ�Ʒ��ڸ���Ʒ�ϵ������Ϊ�ⶨ�Ʋ��ȣ���NaOH��Һ�ܽ����Ʒ��������Ʋ㣬����Ӧת��6mol����ʱ��������������ʵ���Ϊ_____mol
��3��˫�ǻ���̼����[NaAl��OH��2CO3]��һ�ֳ��õĿ���ҩ������θ�ᷴӦ�Ļ�ѧ����ʽΪ_____
��4����ͼ�Ǵ���ʿ����Ҫ�ɷ�ΪAl2O3������������SiO2��Fe2O3�����ʣ�����ȡAl2O3������AlN�Ĺ������̣�
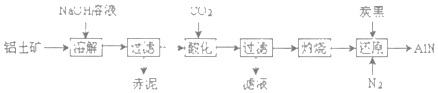
�����ܽ���ʱ��SiO2��NaOH��Һ��Ӧ���ɵĹ���������Һ��ƫ�����Ʒ�����Ӧ��2Na2SiO3+2NaAIO2+2H2O�TNa2Al2Si2O8��+4NaOH���������Ҫ�ɷ�Ϊ_____��д����ѧʽ����
�����ữ��ʱͨ�����CO2��NaAlO2��Ӧ����Al��OH��3��Һ����Ҫ�ɷ�Ϊ_____��д��ѧʽ����
������ԭ��ʱ��̿���ڸ����±�����ΪCO����Ӧ�Ļ�ѧ����ʽΪ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ����˵����ȷ���ǣ� ��
A. ���ݶ����ЧӦ�ɽ���ɢϵ��Ϊ��Һ����������Һ
B. ����ˮ��Ͷ������������������������Ľ��壺Al3+��3H2O![]() Al(OH)3(����)��3H+
Al(OH)3(����)��3H+
C. Na+��K+��SO42-��Br-����Fe(OH)3�����������
D. ��ˮ�еμ���������FeCl3��Һ���γɴ���Ľ��壬����������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������![]() ����ͼ����һ����Ҫ�IJ����м��壬�����йػ�����
����ͼ����һ����Ҫ�IJ����м��壬�����йػ�����![]() ��˵������ȷ����
��˵������ȷ����
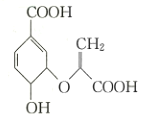
A.�����к������ֹ�����
B.�����Ҵ������ᷴӦ
C.����̼ԭ��һ������ͬһƽ��
D.��ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4����һ�����͡���Ч�������ɫˮ����������ҵ���Ʊ���������Լ�������ش�����ˮ�IJ����������£�
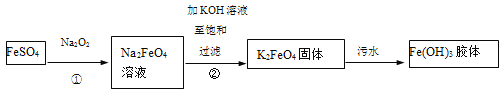
����˵������ȷ����
A.����һ��������������ԭ��Ӧ
B.��ˮ�����в���Fe(OH)3���壬ʹ������۳��������˽�����н�ǿ�����������ص�
C.��һ���ڼ����������Ʊ�K2FeO4�ķ�Ӧ�����ǣ�2Fe(OH)3+3ClO��=2FeO42-+3Cl��+4H+ +H2O
D.K2FeO4���������ڴ�����ˮ��������ѷ�ˮ�е�CN��ת��Ϊ���������壬��Ӧ�����У�CN������ԭ������K2FeO4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������µ���л���ˮ(��CH3COOH)���ɻ�������ԴH2��ԭ����ͼ��ʾ����ȷ���ǣ� ��
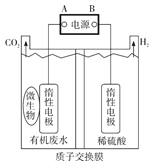
A. ͨ���H+ͨ�����ӽ���Ĥ�����ƶ��������Ҳ���ҺpH��С
B. ��ԴA��Ϊ����
C. ͨ�������22.4LH2���ɣ���ת��2mol����
D. ���ԴA�������Ķ��Ե缫�Ϸ����ķ�ӦΪCH3COOH-8e-+2H2O=2CO2��+8H+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com