
【题目】铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。请完成列空白:
(1)铝元素在周期表中的位置为_____
(2)可以用电镀法在钢制品上电镀铝,为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6mol电子时,所得气体的物质的量为_____mol
(3)双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它和胃酸反应的化学方程式为_____
(4)如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:
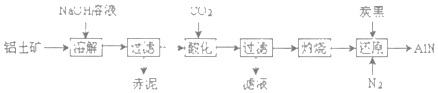
①“溶解”时,SiO2与NaOH溶液反应生成的硅酸钠与溶液中偏铝酸钠发生反应:2Na2SiO3+2NaAIO2+2H2O═Na2Al2Si2O8↓+4NaOH,赤泥的主要成分为_____(写出化学式)。
②“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3滤液的主要成分为_____(写化学式)。
③“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_____
【答案】第三周期,第ⅢA主族 3 NaAl(OH)2CO3+4HCl=NaCl+AlCl3+3H2O+CO2↑ Fe2O3、Na2Al2Si2O8 NaHCO3 Al2O3+N2+3C![]() 2AlN+3CO
2AlN+3CO
【解析】
(1)铝是13号元素,核电荷数13,核外电子数为13,核外三个电子层,最外层3个电子,确定铝元素在周期表中的位置;
(2)铝和氢氧化钠反应的化学方程式分析判断,还原产物为氢气,结合反应定量关系计算;
(3)[NaAl(OH)2CO3]和盐酸反应生成氯化钠、氯化铝、二氧化碳和水;
(4)铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质),铝士矿中加入氢氧化钠溶液,SiO2和Al2O3溶于氢氧化钠溶液,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH,氧化铁不溶于氢氧化钠溶液,所以过滤得赤泥为Fe2O3、Na2Al2Si2O8,滤液主要为偏铝酸钠溶液,偏铝酸钠溶液中通入过量的二氧化碳酸化得沉淀为氢氧化铝,过滤得滤液主要为NaHCO3溶液,氢氧化铝燃烧得氧化铝,氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO。
(1)铝是13号元素,核电荷数13,核外电子数为13,核外三个电子层,最外层3个电子铝元素在周期表中的位置为第三周期,第ⅢA主族,故答案为:第三周期,第ⅢA主族;
(2)铝和氢氧化钠反应的化学方程式分析,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,还原产物为氢气,当反应转移6mol电子时,所得还原产物的物质的量为3mol,故答案为:3;
(3)[NaAl(OH)2CO3]和盐酸反应生成氯化钠、氯化铝、二氧化碳和水,反应的方程式为NaAl(OH)2CO3+4HCl=NaCl+AlCl3+3H2O+CO2↑,故答案为:NaAl(OH)2CO3+4HCl=NaCl+AlCl3+3H2O+CO2↑;
(4)铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质),铝士矿中加入氢氧化钠溶液,SiO2和Al2O3溶于氢氧化钠溶液,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH,氧化铁不溶于氢氧化钠溶液,所以过滤得赤泥为Fe2O3、Na2Al2Si2O8,滤液主要为偏铝酸钠溶液,偏铝酸钠溶液中通入过量的二氧化碳酸化得沉淀为氢氧化铝,过滤得滤液主要为NaHCO3溶液,氢氧化铝燃烧得氧化铝,氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO,
①根据上面的分析可知,赤泥的主要成分为 Fe2O3、Na2Al2Si2O8,故答案为:Fe2O3、Na2Al2Si2O8;
②“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为 NaHCO3,故答案为:NaHCO3;
③氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO,反应的化学方程式为Al2O3+N2+3C![]() 2AlN+3CO,故答案为:Al2O3+N2+3C
2AlN+3CO,故答案为:Al2O3+N2+3C![]() 2AlN+3CO。
2AlN+3CO。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生成等领城应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法 1: 燃煤中加入生石灰,将SO2转化为 CaSO3,再氧化为CaSO4。
已知:a. CaO(s) +CO2 (g)=CaCO3 △H=-1 78.3kJmol-1
b. 2CaCO3(s) +2SO2(g) +O2(g)=2CaSO4(s) +2CO2(g) △H=-2762.2kJmol-1
c.2 CaSO3(s) + O2(g)=2CaSO4(s) △H =-2314.8 kJmol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_____________。
②方法 2:用氨水将SO2转化为NH4HSO3 ,再氧化为(NH4)2SO4。实验测得NH4HSO3溶液中![]() = 1500 ,则溶液的pH 为_____________(已知:HSO3-的Ka1=1.5×l0-2, Ka2=l.0×l0-7)。
= 1500 ,则溶液的pH 为_____________(已知:HSO3-的Ka1=1.5×l0-2, Ka2=l.0×l0-7)。
(2)煤制得的化工原料气中含有羰基硫(O=C =S),该物质可转化为H2S,反应为COS(g)+ H2( g ) ![]() H2S(g) +CO(g) △H > 0。
H2S(g) +CO(g) △H > 0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是________________(填字母)。
a.COS的浓度保持不变 b. 化学平衡常数不再改变
c.混合气体的密度不再改变 d. 形成 2 mol H-S 键的同时形成 1 mol H-H 键
②T℃时 ,在恒容的密闭容器中 ,将定量的CO和H2S 混合加热并达到下列平衡:H2S(g) + CO(g)![]() COS(g) + H2(g),K=0.25,则该温度下反应 COS(g) +H2(g)=H2S(g) +CO(g)的平衡常数K __________。T1℃ 时,向容积为 10 L 的恒容密闭容器中充入 1 molCOS(g)和1 mol H2 (g),达到平衡时 COS 的转化率为_______。
COS(g) + H2(g),K=0.25,则该温度下反应 COS(g) +H2(g)=H2S(g) +CO(g)的平衡常数K __________。T1℃ 时,向容积为 10 L 的恒容密闭容器中充入 1 molCOS(g)和1 mol H2 (g),达到平衡时 COS 的转化率为_______。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式如图所示: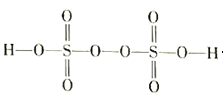
①在Ag+催化作用下,S2O82-能与 Mn2+ 在水溶液中发生反应生成SO42-和 MnO4-,1 molS2O82-能氧化的 Mn2+ 的物质的量为_____________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
(4)NaHS 可用作处理含 Hg2+的污水的沉淀剂,已知 25℃时,反应 Hg2+(aq) + HS-( aq) ![]() HgS(s) + H+(aq) 的平衡常数 K=l.75×l038 ,H2S的电离平衡常数Ka1=1.3×l0-7 , Ka2= 7.0×l 0-15,则Ksp(HgS) =__________________。
HgS(s) + H+(aq) 的平衡常数 K=l.75×l038 ,H2S的电离平衡常数Ka1=1.3×l0-7 , Ka2= 7.0×l 0-15,则Ksp(HgS) =__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用下列装置探究氯气与氨气的反应.其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

(1)若Cl2从左向右流动,NH3从右向左流动,则上述实验装置中,依次连接的合理顺序为:A→________________→B;为使NH3与Cl2更充分混合,Cl2应从C装置的__口进入(填“x”或“y”).
(2)简述装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是__________________.
(3)装置A中发生反应的离子方程式为_______________________________.
(4)装置B中圆底烧瓶内的试剂为______________(填名称).
(5)装置D的作用是____________________________.
(6)反应开始后,装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中的主要成分之一,该反应的化学方程式为________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )
2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )

A. 催化剂失效 B. 减小生成物的浓度
C. 降低体系温度 D. 增大容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g)![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1L容器中加入1mol A和1mol B发生反应,下列叙述能作为该反应达到平衡状态的标志的是( )
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1L容器中加入1mol A和1mol B发生反应,下列叙述能作为该反应达到平衡状态的标志的是( )
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化
A. ③④B. ①②C. ③⑤D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO在工农业生产中有着重要的应用。
(1)CO是制备很多有机物(如甲醇、乙醇、甲醚等)的原料,现用CO与H2合成甲醇,反应如下:CO(g)+2H2(g)= CH3OH(g) △H=-99kJmol–1。
①已知断裂1molCO(g)中的化学键消耗的能量为1072kJ,断裂1molH2(g)中的化学键消耗的能量为436kJ,则形成1molCH3OH(g)中化学键释放的能量为_____。
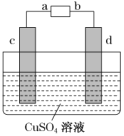
②用CH3OH 燃料电池电解精炼粗铜,装置如图所示。当消耗1mol甲醇时,d极质量增加了160g,则甲醇应加入____(填“a”或“b”)极,该电池的能量转化率为________(保留3位有效数字)。
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂。Ni的羰化反应为Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
Ni(CO)4(g) △H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的![]() 倍。则:
倍。则:
①0~10min内平均反应速率v(Ni)=________gmin–1。
②研究表明正反应速率v正=k正x4(CO),逆反应速率v逆 =k逆x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),则T0温度下,![]() =_____。
=_____。
③当温度升高时k正_______k逆(填“大于”“小于”或“等于”),此时CO的转化率___________(填“变大”“变小”或“不变”)。
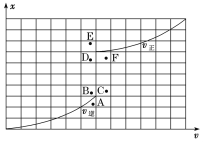
④T1温度下测得一定的实验数据,计算得到v正~x(CO)和v逆~x[Ni(CO)4]的关系可用如图进行表示。当降低温度时,反应重新达到平衡,相应的点分别为______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
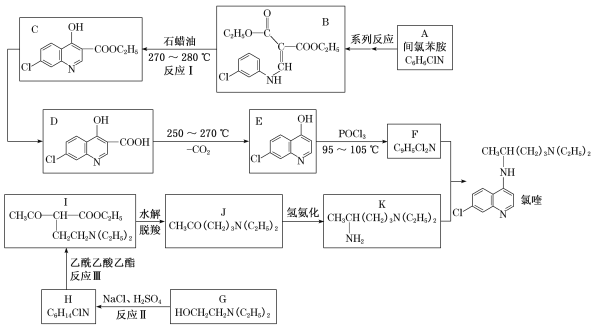
【题目】磷酸氯喹治疗新冠肺炎具有一定疗效。磷酸氯喹由氯喹与磷酸制备,下面是由间氯苯胺合成氯喹的一种合成路线:
回答下列问题:
(1)已知反应I是B→C+X,推测X的名称是______,D中含氧官能团的名称是____。
(2)F的结构简式为_______________,反应II的反应类型是___________。
(3)反应III的化学方程式为____________。
(4)化合物M(C7H8ClN)是A的同系物,其某些同分异构体的核磁共振氢谱有4组峰,峰面积比为1:1:1:1,符合该要求的同分异构体有_________种。
(5)设计由氯化芐(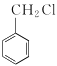 )和乙酰乙酸乙酯为原料制备
)和乙酰乙酸乙酯为原料制备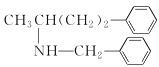 的合成路线(无机试剂任选)________。
的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L。
(1)求该反应的平衡常数______。
(2)在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为2019年我国电动汽车的新能源,其电极材料可表示为![]() +3
+3![]() ,且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
,且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
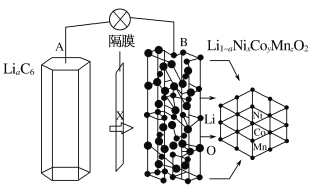
A.允许离子X通过的隔膜属于阴离子交换膜
B.充电时,A为阴极,Li+被氧化
C.可从无法充电的废旧电池的石墨电极中回收金属锂
D.放电时,正极反应式为Li1-aNixCoyMnzO2+aLi++ae-===LiNixCoyMnzO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com