
����Ŀ����һƿ��ɫ�������Һ�����п��ܺ�NH4+��K+��Na+��Mg2+��H+��Cu2+��CO32-��I-�е�һ�ֻ��֣�ȡ����Һ��������ʵ�飺
����PH��ֽ���飬������Һ��ǿ����
��ȡ������Һ������������CCl4���������Ƶ���ˮ����CCl4������ɫ
����ȡ������Һ����μ���ϡNaOH��Һ��ʹ��Һ��������ת��Ϊ���ԣ��ڵμӹ����м��μ���Ϻ���Һ�о���������
�ܽ��۵õ��ļ�����Һ���ȣ�������ų�����������ʹʪ��ĺ�ɫʯ����ֽ������
��������ʵ����ʵȷ�����ش�
(1)����Һ�У��϶����ڵ���___________���϶������ڵ�������__________________��
(2)д��ʵ����е����ӷ�Ӧ����ʽ________________________��
(3)����ȷ���Ƿ���ڵ�������__________________________��
���𰸡�I-��NH4+��H+ CO32- ��Mg2+ ��Cu2+ 2I- + Cl2��I2 + 2Cl- K+��Na+
��������
����ʵ���������Һ��ǿ���ԣ�˵����Һ�п϶�����H+����H+��CO32-������Ӧ�����ܹ��棬˵����Һ�п϶�������CO32-������ʵ�������CCl4����Ϻ�ɫ��˵����I2���ɣ���������I-�����������������ģ��Ӷ�˵����Һ�к���I-������ʵ���������Һ��������Ϊ���ԣ��ڵμӹ����к͵μ���Ϻ���Һ��������������Mg2+��Cu2+����Ӧ����������˵����Һ�п϶�������Mg2+��Cu2+������ʵ�����������������ʹʪ��ĺ�ɫʯ����ֽ������������Ϊ�������������� NH4++OH-![]() NH3��+H2O�������Һ�п϶�����NH4+���������������ṩ�������п϶����е�����Ϊ��H+��I-��NH4+���϶������е�����Ϊ��Mg2+��Cu2+��CO32-��������ȷ��������Ϊ��K+��Na+��Ҫȷ��K+��Na+������Ҫͨ����ɫ��Ӧ����ɣ�������ɫ��Ӧʵ�飬�л�ɫ������Na+����ɫ������Na+������ɫ�ܲ����۲죬����ɫ������K+������ɫ������K+��
NH3��+H2O�������Һ�п϶�����NH4+���������������ṩ�������п϶����е�����Ϊ��H+��I-��NH4+���϶������е�����Ϊ��Mg2+��Cu2+��CO32-��������ȷ��������Ϊ��K+��Na+��Ҫȷ��K+��Na+������Ҫͨ����ɫ��Ӧ����ɣ�������ɫ��Ӧʵ�飬�л�ɫ������Na+����ɫ������Na+������ɫ�ܲ����۲죬����ɫ������K+������ɫ������K+��
(1)�ɷ�����֪������Һ�У��϶����ڵ���I-��NH4+��H+���϶������ڵ�������CO32- ��Mg2+ ��Cu2+��
(2) ʵ�������CCl4����Ϻ�ɫ��˵����I2���ɣ���������I-�����������������ģ����ӷ�Ӧ����ʽΪ��2I- + Cl2��I2 + 2Cl-��
(3) ����ȷ���Ƿ���ڵ�������K+��Na+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ�ط���վ������ͨ��������վ��ȣ����к����ŷ��٣����������ͣ�����Ϊ����ɫ������վ����ͼΪij����ȼ�ϵ�ع���ԭ��������˵���������
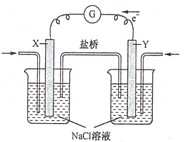
A.�õ�ع���ʱ��X�缫��������ҺpH����
B.�õ�ع���ʱ�������е���������Y�缫�ƶ�
C.���ü״���ȼ�ϣ���X�缫�ϵķ�ӦΪCH3OH-6e-+H2O=CO2+6H+
D.���ü�����ȼ�ϣ�����·��ͨ��0.8mol����ʱ�������ļ��������Ϊ1.6g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(B)���仯�����ڻ�ѧ��ҵ���������;����ش���������:
(1)���⻯��(NaBH4)�������Ҫ�����
��NaBH4��B�Ļ��ϼ�Ϊ_______________��
�ڹ�ҵ�Ͽ������������[B(OCH3)3]���⻯��(NaH)��Ӧ�Ʊ�NaBH4��Ӧ�����ֲ���Ϊ�״���(CH3ONa)���÷�Ӧ�Ļ�ѧ����ʽΪ______________________��
��NaBH4��ˮ��Ӧ����NaBO2��H2���÷�Ӧ���ɵ����������뻹ԭ��������ʵ���֮��Ϊ____________________��
(2)��ҵ���������(��Ҫ�ɷ�ΪMg2B2O5H2O,��������Fe2O3��FeO��CaO��Al2O3��SiO2��)Ϊԭ���Ʊ�����B�Ĺ���������ͼ��ʾ:
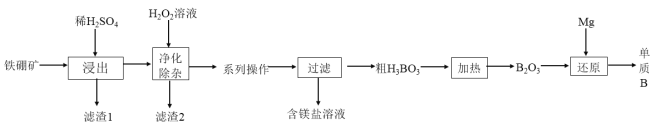
��֪:��ؽ������������������������pH����������:
�������� | Fe3+ | Al3+ | Fe2+ | Mg2+ |
��ʼ������pH | 2.7 | 3.7 | 5.8 | 9.6 |
��ȫ������pH | 3.7 | 4.7 | 8.8 | 11 |
��ش���������:
�١�������ʱ.�������ʯ�����Ŀ��Ϊ___________________________��д��Mg2B2O5H2O�����ᷴӦ�Ļ�ѧ����ʽ:____________________��
������1����Ҫ�ɷ�Ϊ_____________________________��
�ۡ��������ӡ�ʱ���ȼ�H2O2��Һ,��Ŀ��Ϊ_______________��Ȼ���ٵ�����Һ��pH��5,��Ŀ����___________________________________��
���ƵõĴ�����һ��������������BI3 , BI3���ȷֽ���Եõ������ĵ������ֽ�0.025 g�����Ƴɵ�BI3��ȫ�ֽ�,���ɵ�I2��0.30 molL-1 Na2S2O3��Һ�ζ�(I2 +2S2O32-=2I-+ S4O6 2-)���յ㣬���� 18.00 mLNa2S2O3��Һ:ʢװNa2S2O3��ҺӦ��_____________���ʽ����ʽ��)�ζ��ܣ��ô�����Ʒ�Ĵ���Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����(����)
A. ���³�ѹ�£�2.24 L H2O�к��м��Թ��ۼ�����ĿΪ0.2NA
B. 0.1 mol��L��1NH4Cl��Һ�к���NH![]() ����ĿС��0.1NA
����ĿС��0.1NA
C. 100 mL 12 mol��L��1��ŨHNO3�����Cu��Ӧת�Ƶ��ӵ���ĿΪ0.6NA
D. ��״���£�11.2 L��CH4��C2H4��ɵĻ�������к�����ԭ�ӵ���ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪����ʱ��0.1 mol/L������ˮ����0.1%�������룬�����Һ��pH��__������ĵ���ƽ�ⳣ��K��__��
��2�������������μ�ˮ����Һ�����������ˮ������仯����ͼ��ʾ��
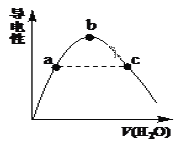
�� a��b��c������Һ��CH3COOH�ĵ���̶��ɴ�С��˳����_____________��
�� a��c�����Ӧ����Һ�ֱ����հ�����������Һ����pH��Ϊ7��25��ʱ������a ����Һ�е�c(CH3COO��) __c����Һ�е�c(NH4+)��(������������������������)
��3����֪25��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ���ش��������⣺
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | Ka=1.8 | Ka1=4.3 | Ka=3.0 |
�����ʵ���Ũ�Ⱦ�Ϊ0.1mol/L��������Һ��pH��С�������е�˳����______(�ñ����д)��
a��CH3COONa b��Na2CO3 c��NaClO d��NaHCO3
��д�������������Һ��ͨ������������̼�����ӷ���ʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ������SiO2 ��̼��Ӧ����ȡ�裬д����Ӧ�Ļ�ѧ����ʽ___________________��
��ҵ�ϻ���������þ��ȡ�裬��ӦΪ2Mg+SiO2 = 2MgO+Si��ͬʱ�ᷢ������Ӧ��2Mg + Si = Mg2Si����ͼ�ǽ���Mg��SiO2��Ӧ��ʵ��װ�ã��Իش��������⣺

��1������O2��H2O��g���Ĵ��ڶԸ�ʵ���нϴ�Ӱ�죬ʵ����Ӧͨ������X��Ϊ���������Թ��еĹ���ҩƷ��ѡ��________(�����)��
a��ʯ��ʯ������b��п��������c������
��2��ʵ�鿪ʼʱ��������ͨһ��ʱ��X���壬�ټ��ȷ�Ӧ��������� ___________________________������Ӧ���������߾ƾ��ƣ���Ӧ�ܼ������У���ԭ����______________________��
��3����Ӧ��������ȴ������ʱ������Ӧ��Ļ�����м���ϡ���ᣬ�ɹ۲쵽�����Ļ��ǣ������������ԭ���Ǹ�����Mg2Si������Ѹ�ٷ�Ӧ����SiH4�����飩���壬Ȼ��SiH4��ȼ���û�ѧ����ʽ��ʾ��������Ӧ��________________________��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ:A(g)+B(g) ![]() C(s)+2D(g)����H>0,��ͼ��ʾΪ���淴Ӧ����(v)��ʱ��(t)�Ĺ�ϵ,�����t1ʱ�̸ı���������:�ټ���A;�ڼ������;�ۼ�ѹ;������;������C,����ͼʾ��������(����)��
C(s)+2D(g)����H>0,��ͼ��ʾΪ���淴Ӧ����(v)��ʱ��(t)�Ĺ�ϵ,�����t1ʱ�̸ı���������:�ټ���A;�ڼ������;�ۼ�ѹ;������;������C,����ͼʾ��������(����)��
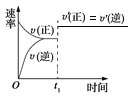
A. �ڢ�B. �٢�C. �ۢ�D. �ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������仯ʾ��ͼ�������Ȼ�ѧ����ʽ��ȷ����

A. 2A��g��+ B(g)=2C��g����H=a��a��0��B. 2A��g��+ B(g)=2C��g����H=a��a��0��
C. 2A + B=2 C��H=a��a��0��D. 2C=2A +B��H=a��a��0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�У�����������ԭ��Ӧ���ǣ� ��
A.3NO2 + H2O = 2HNO3 + NOB.2 H2+O2![]() 2H2O
2H2O
C.Cl2��H2O=HClO��HClD.CuCl2��Ba(OH)2=Cu(OH)2��BaCl2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com