
【题目】![]() 反应过程的能量变化如图所示,请回答下列问题:
反应过程的能量变化如图所示,请回答下列问题:
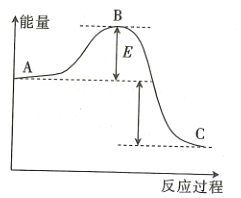
(1)该反应是______________(填“放热”或“吸热”)反应。
(2)用![]() 作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
(3)在体积为2L的恒容密闭容器中通入2mol![]() 和3mol
和3mol![]() 发生上述反应,10min内
发生上述反应,10min内![]() 的物质的量变化如下表:
的物质的量变化如下表:
反应时间(min) | 0 | 3 | 5 | 7 | 10 |
| 0 | 0.2 | 0.3 | 0.38 | 0.38 |
①升高温度,反应速率______________(填“增大”或“减小”)。
②上述反应在7min时_______________(填“达到”或“未达到”)平衡状态。
③![]() min内,用
min内,用![]() 表示该反应的反应速率为_______________mol·L-1·min-1。
表示该反应的反应速率为_______________mol·L-1·min-1。
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】聚合硫酸铁是水处理中重要的絮凝剂。以黄铁矿的烧渣![]() 主要成分为Fe2O3、FeO、SiO2等
主要成分为Fe2O3、FeO、SiO2等![]() 为原料制取聚合硫酸铁(Fe2(OH)x(SO4)(3-
为原料制取聚合硫酸铁(Fe2(OH)x(SO4)(3-![]() ))的工艺流程如图所示:
))的工艺流程如图所示:
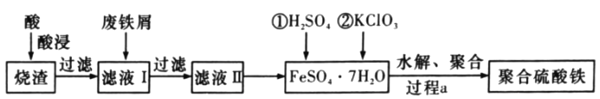
(1)“酸浸”时最合适的酸是______![]() 写化学式
写化学式![]() 。
。
(2)“酸浸”后溶液中主要的金属阳离子有______。
(3)加入KClO3的目的是______(结合离子方程式说明)。
(4)“过程a”中生成聚合硫酸铁的过程是先水解再聚合,将下列水解反应原理的化学方程式补充完整。Fe2(SO4)3+______H2O![]() ______Fe2(OH)x(SO4)(3-
______Fe2(OH)x(SO4)(3-![]() )+______。
)+______。
(5)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。已知盐基度B的表达式为B=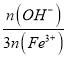 ×100%(n为物质的量
×100%(n为物质的量![]() 。为测出聚合硫酸铁的盐基度,进行如下实验操作:
。为测出聚合硫酸铁的盐基度,进行如下实验操作:
![]() 取聚合硫酸铁样品mg,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应,然后以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0mL。
取聚合硫酸铁样品mg,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应,然后以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0mL。
![]() 做空白对比实验:取与步骤i等体积等浓度的盐酸,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液VmL。
做空白对比实验:取与步骤i等体积等浓度的盐酸,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液VmL。
①该聚合硫酸铁样品中,n(OH-)=______mol。
②已知该样品中Fe的质量分数为![]() ,则盐基度B=______。
,则盐基度B=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬的化合物在医药、材料领域有重要作用,认识铬及其化合物有重要意义。
(1)基态铬原子中,电子占据的最高能级符号为_____________。
(2)研究表明,当化合物的阳离子有未成对电子时,该化合物具有磁性。下列物质可用作录音带磁粉的是__________。
A.V2O5 B.Fe2O3 C.ZnO D.CrO2
(3)已知Cr3+在水溶液中的存在形式为[Cr(H2O)6]3+。在不同条件下,可从CrCl3水溶液中获得紫色、蓝绿色或绿色等不同颜色的配合物,其实验式均为CrCl36H2O。现取蓝绿色配合物0.1mol,加入足量AgNO3溶液,经过滤、洗涤、干燥得28.7g沉淀,则该化合物中的化学键类型有___________,写出该蓝绿色配合物的电离方程式:________。
(4)常温下,氯化酰铬(CrO2Cl2)是暗红色液体,能与CCl4、CS2等有机溶剂互溶。
①固体氯化酰铬属于______(填“极性”或“非极性”)分子,判断依据是______。
②等电子体是具有相同的价电子数和原子数的分子或离子。写出一种与CCl4分子互为等电子体的阴离子:_______(填化学式);写出CS2分子的电子式:____________。
(5)氮化铬(CrN)在超级电容器领域有良好应用前景,其晶体结构类型与氯化钠相同。
①氮化铬的熔点比氯化钠高的主要原因是______。
②与Cr3+次邻近的N3–有________个。
③已知Cr3+和N3–半径分别为apm、bpm,设Cr3+和N3–都是紧密接触的刚性小球,NA代表阿伏加德罗常数的值,晶体的密度为ρgcm–3,则CrN的摩尔质量为______。(用含a、b、NA、ρ的算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g) ΔH=Q kJ·mol-1。在T℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T℃时,该反应的平衡常数K=________。
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积 d.升高反应体系温度 e.同时加入0.2mol B、0.1mol D、0.1mol E
(3)写出下列电解质在水中的电离方程式:
CH3COOH:____________NaHSO4:______ NaHCO3:_________H2CO3:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验 | 现象 |
| ①中溶液变蓝且无其他明显现象 |
②中无明显现象 | |
③中溶液褪色 | |
④中产生黄绿色气体 |
下列分析正确的是( )
A.①中现象体现了浓盐酸的氧化性
B.②中现象说明未发生反应
C.③中反应后氯元素全部以KCl形式存在
D.④中产生黄绿色气体的反应是:ClO-+ Cl-+ 2H+ = Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料MnxZn(1-x)Fe2O4,其工艺流程如图所示:
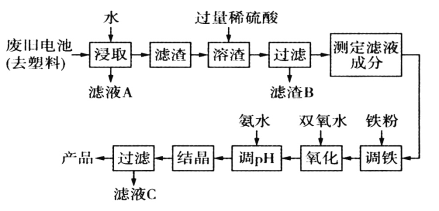
(1)滤液A中溶质的电子式为____________。
(2)已知MnxZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为_________。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_____________________________。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1-X)Fe2O4相符合。
①写出“调铁"工序中发生反应的离子方程式:_________________,___________________。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=amol.L-1,c(Fe2+)+c(Fe3+)=bmol.L-1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为________kg(忽略溶液体积变化,用含a、b的代数式表示)。
(5)在“氧化"工序中,加入双氧水的目的是把Fe2+氧化为Fe3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是_______________。
(6)用氨水“调pH"后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
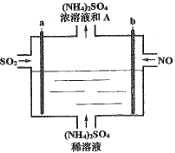
A.每处理lmol NO可以生成2mol A
B.a与电源负极相连,发生还原反应
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2∶5通入装置可彻底转化
查看答案和解析>>
科目:高中化学 来源: 题型:
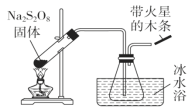
【题目】过硫酸钠(Na2S2O8)具有极强的氧化性,且不稳定,某化学兴趣小组探究过硫酸钠的相关性质,实验如下。已知SO3是无色易挥发的固体,熔点16.8℃,沸点44.8℃。
(1)稳定性探究(装置如图):
分解原理:2Na2S2O8![]() 2Na2SO4+2SO3↑+O2↑。
2Na2SO4+2SO3↑+O2↑。
此装置有明显错误之处,请改正:______________________,水槽冰水浴的目的是____________________;带火星的木条的现象_______________。
(2)过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为______________________,该反应的氧化剂是______________,氧化产物是________。
(3)向上述溶液中加入足量的BaCl2,过滤后对沉淀进行洗涤的操作是___________________________。
(4)可用H2C2O4溶液滴定产生的紫红色离子,取20mL待测液,消耗0.1mol·L-1的H2C2O4溶液30mL,则上述溶液中紫红色离子的浓度为______mol·L-1,若Na2S2O8有剩余,则测得的紫红色离子浓度将________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )

A.原子半径:Z>Y>X>W
B.氢化物的沸点:Y>X>Z>W
C.X的氧化物的水化物是强酸
D.Y的某种单质具有杀菌消毒作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com