
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )

A.原子半径:Z>Y>X>W
B.氢化物的沸点:Y>X>Z>W
C.X的氧化物的水化物是强酸
D.Y的某种单质具有杀菌消毒作用
【答案】D
【解析】
由新型漂白剂的结构可知,W形成的价键数为4,X形成的价键数为3,Y形成的价键数为2,Z形成的价键数为1;W、X、Y、Z均为短周期元素且原子序数依次增大,常温下,0.1mol/LZ的氢化物的水溶液pH=1,则Z为Cl;Z与Y位于不同周期,则Y为O元素、W为C元素、X为N元素,据此分析解题。
由分析知:W为C元素、X为N元素、Y为O元素、Z为Cl元素;
A.C、N、O为同周期主族元素,核电荷数越大,原子半径越小,C、N、O、Cl四种元素的原子半径由大到小的顺序为Cl>C>N>O,即Z>W>X>Y,故A错误;
B.H2O常温下为液体,NH3和H2O分子间存在氢键,四种元素简单氢化物的沸点由高到低的顺序为H2O>NH3>HCl>CH4,但C的氢化物包括多碳的烃,常温下有固体,有液体,即碳的氢化物沸点也可能比H2O高,故B错误;
C.N的最高价氧化物的水化物HNO3是强酸,而+3价N的氧化物水化物HNO2是弱酸,故C错误;
D.O3具有强氧化性,具有杀菌消毒作用,故D正确;
故答案为D。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】![]() 反应过程的能量变化如图所示,请回答下列问题:
反应过程的能量变化如图所示,请回答下列问题:
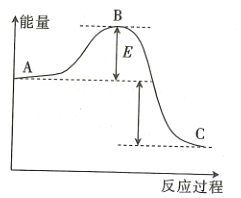
(1)该反应是______________(填“放热”或“吸热”)反应。
(2)用![]() 作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
(3)在体积为2L的恒容密闭容器中通入2mol![]() 和3mol
和3mol![]() 发生上述反应,10min内
发生上述反应,10min内![]() 的物质的量变化如下表:
的物质的量变化如下表:
反应时间(min) | 0 | 3 | 5 | 7 | 10 |
| 0 | 0.2 | 0.3 | 0.38 | 0.38 |
①升高温度,反应速率______________(填“增大”或“减小”)。
②上述反应在7min时_______________(填“达到”或“未达到”)平衡状态。
③![]() min内,用
min内,用![]() 表示该反应的反应速率为_______________mol·L-1·min-1。
表示该反应的反应速率为_______________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2O中含有氢原子数目为2NA
B.17 g NH3所含质子数为10NA
C.0.1 mol Cu(NO3)2中含有的离子数目为0.2NA
D.28 g N2体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】450℃时,在某恒容密闭容器中存在反应:C(s)+2NO(g)![]() N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
A. 容器内压强保持不变B. v正(N2)=2v逆(NO)
C. N2与CO2的物质的量之比为1∶1D. 容器内混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。
(1)在标准状态下,由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成焓。各物质的标准摩尔生成焓如表:

则制备合成气的反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)在标准状态下的反应热ΔH=___kJ/mol。
2CO(g)+2H2(g)在标准状态下的反应热ΔH=___kJ/mol。
(2)在刚性容器中,当投料比![]() =1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
=1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
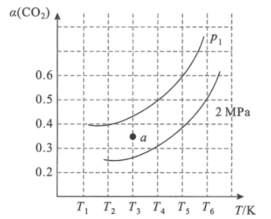
①由图可知:压强P1___2MPa(填“>”、“<”或“=”),理由是___。
②当温度为T3、压强为p1时,a点的v正___v逆(填“>”、“<”或“=”)。
③若起始时提高投料比![]() ,则CO2的平衡转化率将___(填“升高”或“降低”)。
,则CO2的平衡转化率将___(填“升高”或“降低”)。
④起始时向容器中加入1molCH4和1molCO2,在温度为T6。、初始压强为2MPa时反应,该反应的Kp=___(MPa)2。
(3)该催化重整过程中有副产物碳生成,碳的积累会严重影响催化剂的活性。某研究小组计算和模拟实验表明积碳量(催化剂表面碳的质量与催化剂的质量之比)与投料比、温度的关系如图。
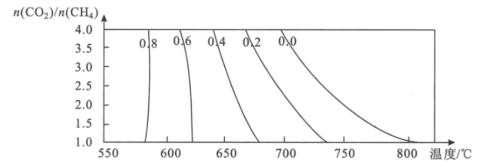
当投料比![]() =2.0时,要使积碳量最小,应调节温度为___℃。
=2.0时,要使积碳量最小,应调节温度为___℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物是重要的合金材料和催化剂。
(1)基态镍原子的价电子排布式为___,它核外有___种运动状态不同的电子。
(2)Ni2+可以形成多种配离子,比如[Ni(NH3)4]2+、[Ni(CN)4]2-等。CN-中碳原子的杂化方式为___,与CN-互为等电子体的一种分子是___。[Ni(NH3)4]2+中H-N-H键角比NH3分子中H-N-H键角___(填“大”、“小”或“相等”),原因是___。
(3)元素铜与镍的第二电离能分别为:I2(Cu)=1958kJ/mol、I2(Ni)=1753kJ/mol,铜的第二电离能更大的原因是___。
(4)NiO的晶体结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___。
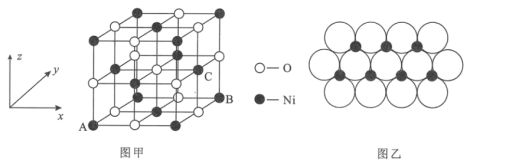
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数的值为NA,每平方米面积上分散的该晶体的质量为___g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在工农业生产及航天航空业中具有广泛的用途。回答下列问题:
⑴NF3为无色、无味的气体,可用于微电子工业,该物质在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为______,NF3在空气中泄漏时很容易被观察到,原因是_______。
⑵汽车尾气中催化剂可将NO、CO转化成无害气体。
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能/kJ·mol1 | 1076 | 630 | 945 | 803 |
2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH
①ΔH=______________________________kJ·mol1。
②该反应的平衡常数与外界因素X(代表温度、压强、![]() 或催化剂接触面)关系如下图所示。
或催化剂接触面)关系如下图所示。
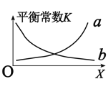
X是______,能正确表达平衡常数K随X变化的曲线是_______(填:a或b)。
⑶在一定温度和催化剂作用下,8NH3(g)+8NO(g)+2NO2(g)9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟时达到平衡时,c(NH3)=0.5mol·L1,c(NO2)=0.25mol·L1。
①n=_____;
②υ(NO)=______;
③NH3的平衡转化率为_________。
⑷用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将____________(填:增大、减小或不变)。阳极的电极反应式为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是
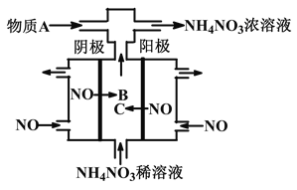
A. 阳极的电极反应式为:NO-3e-+2H2O=NO2-+4H+
B. 物质B与物质C是同一种物质
C. A物质可为氨气
D. 阴、阳两极转移的电子数之比为5∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com