
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。
(1)在标准状态下,由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成焓。各物质的标准摩尔生成焓如表:

则制备合成气的反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)在标准状态下的反应热ΔH=___kJ/mol。
2CO(g)+2H2(g)在标准状态下的反应热ΔH=___kJ/mol。
(2)在刚性容器中,当投料比![]() =1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
=1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
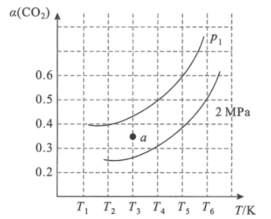
①由图可知:压强P1___2MPa(填“>”、“<”或“=”),理由是___。
②当温度为T3、压强为p1时,a点的v正___v逆(填“>”、“<”或“=”)。
③若起始时提高投料比![]() ,则CO2的平衡转化率将___(填“升高”或“降低”)。
,则CO2的平衡转化率将___(填“升高”或“降低”)。
④起始时向容器中加入1molCH4和1molCO2,在温度为T6。、初始压强为2MPa时反应,该反应的Kp=___(MPa)2。
(3)该催化重整过程中有副产物碳生成,碳的积累会严重影响催化剂的活性。某研究小组计算和模拟实验表明积碳量(催化剂表面碳的质量与催化剂的质量之比)与投料比、温度的关系如图。
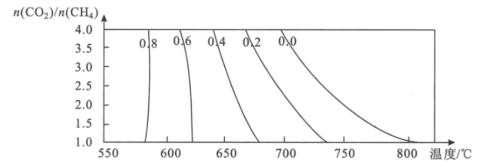
当投料比![]() =2.0时,要使积碳量最小,应调节温度为___℃。
=2.0时,要使积碳量最小,应调节温度为___℃。
【答案】+247 < 该正反应气体分子数增加,其它条件相同时,减小压强,平衡正向移动,CO2的平衡转化率增大 > 升高 4 750
【解析】
(1)ΔH=生成物的标准摩尔生成焓和-反应物的标准摩尔生成焓和;
(2)①在恒温条件下,压强增大,平衡向气体总物质的量减小的方向移动;
②当温度为T3、压强为p1时,a点在曲线下方,未达到平衡,且平衡状态时,CO2的转化率增大;
③起始时提高投料比![]() ,即增大n(CH4)的量,平衡正向进行;
,即增大n(CH4)的量,平衡正向进行;
④起始时向容器中加入1molCH4和1molCO2,在温度为T6,初始压强为2MPa时反应,达到平衡时CO2的转化率为50%,则:
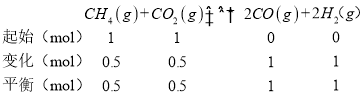
平衡时CH4和CO2的体积分数均为![]() ,CO和H2的体积分数均为
,CO和H2的体积分数均为![]() ,Kp=
,Kp=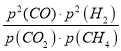 ;
;
(3)结合积碳量与投料比、温度的关系图分析当碳积量最小时,选择温度调节范围。
(1)CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)在标准状态下的反应热ΔH=(-111kJ/mol)×2-(-75kJ/mol)- (-394kJ/mol)=+ 247kJ/mol;
2CO(g)+2H2(g)在标准状态下的反应热ΔH=(-111kJ/mol)×2-(-75kJ/mol)- (-394kJ/mol)=+ 247kJ/mol;
(2)①已知CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的正反应气体分子数增加,在恒温条件下,减小压强,平衡正向移动,CO2的平衡转化率增大,即压强P1<2MPa;
2CO(g)+2H2(g)的正反应气体分子数增加,在恒温条件下,减小压强,平衡正向移动,CO2的平衡转化率增大,即压强P1<2MPa;
②当温度为T3、压强为p1时,a点趋于平衡状态时,CO2的转化率增大,说明此时向正反应方向进行,即v正>v逆;
③起始时提高投料比![]() ,即增大n(CH4)的量,平衡正向进行,则CO2的平衡转化率将升高;
,即增大n(CH4)的量,平衡正向进行,则CO2的平衡转化率将升高;
④起始时向容器中加入1molCH4和1molCO2,在温度为T6,初始压强为2MPa时反应,达到平衡时CO2的转化率为50%,则:
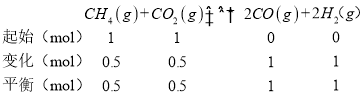
平衡时CH4和CO2的体积分数均为![]() ,CO和H2的体积分数均为
,CO和H2的体积分数均为![]() ,平衡时总压强p=2Mp×
,平衡时总压强p=2Mp×![]() =3 Mp,则Kp=
=3 Mp,则Kp= 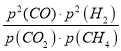 =
= 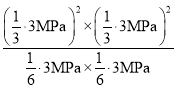 =4(MPa)2;
=4(MPa)2;
(3)当投料比![]() =2.0时,要使积碳量最小,根据积碳量与投料比、温度的关系图可知,应调节温度在750℃左右。
=2.0时,要使积碳量最小,根据积碳量与投料比、温度的关系图可知,应调节温度在750℃左右。


科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料MnxZn(1-x)Fe2O4,其工艺流程如图所示:
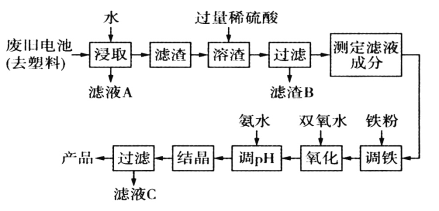
(1)滤液A中溶质的电子式为____________。
(2)已知MnxZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为_________。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_____________________________。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1-X)Fe2O4相符合。
①写出“调铁"工序中发生反应的离子方程式:_________________,___________________。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=amol.L-1,c(Fe2+)+c(Fe3+)=bmol.L-1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为________kg(忽略溶液体积变化,用含a、b的代数式表示)。
(5)在“氧化"工序中,加入双氧水的目的是把Fe2+氧化为Fe3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是_______________。
(6)用氨水“调pH"后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写错误的是( )
A. NaHCO3===Na++H++![]()
B. NH4NO3===![]() +
+![]()
C. NaHSO4===Na++H++![]()
D. Ba(OH)2===Ba2++2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究FeSO4的热分解产物的实验装置如图所示,乙和丙中盛有检验相应物质的常用试剂,实验完成后甲中残留固体为红棕色。下列有关实验操作或现象的叙述正确的是( )

A.实验过程中持续通氮气的目的是排除装置内空气
B.用盐酸和K3[Fe(CN)6]溶液检验残留固体的主要成分
C.乙装置中生成白色沉淀、丙装置中溶液褪色
D.丁装置中所盛装的试剂可用澄清石灰水替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )

A.原子半径:Z>Y>X>W
B.氢化物的沸点:Y>X>Z>W
C.X的氧化物的水化物是强酸
D.Y的某种单质具有杀菌消毒作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCl2、BaCO3、BaSO4的化工厂,利用钡泥制取Ba(NO3)2,其部分工艺流程如图:
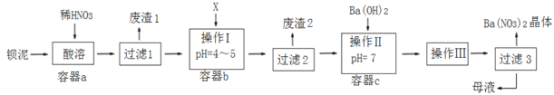
已知:①Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小
下列有关说法不正确的是( )
A. 过滤2后滤液中含有硝酸,操作Ⅱ加入氢氧化钡中和得到硝酸钡溶液
B. X试剂应选过量的H2O2,目的是为了使溶液中的Fe2+转化为Fe3+,最终转化为Fe(OH)3沉淀
C. 操作Ⅲ蒸发结晶、冷却结晶
D. 此工艺流程生产流程会有氮的氧化物造成造成大气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
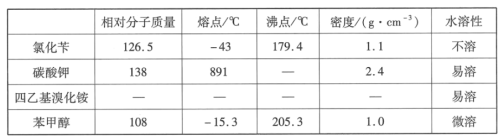
【题目】苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲醇的反应原理和有关数据如图:
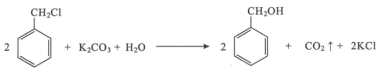
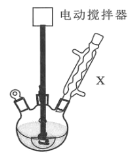
实验步骤:如图所示,在装有电动搅拌器的250mL三颈烧瓶里加入9.0g碳酸钾(过量),70.0mL水,加热溶解,再加入2.0mL四乙基溴化铵[(CH3CH2)4NBr]溶液和10.0mL氯化苄。搅拌加热回流反应1~1.5h。反应结束后冷却,并转入125mL分液漏斗中,分出有机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,收集200~208℃的馏分,得8.4mL苯甲醇。
回答下列问题:
(1)仪器X的名称是___,冷却水应从___(填“上口”或“下口”)通入。由于苯甲醇的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是___(填字母)。
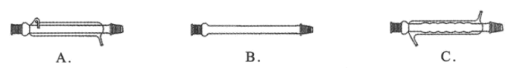
(2)本实验中加入无水硫酸镁的目的是___。从绿色化学角度考虑,萃取剂宜采用___(填字母)。
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法___(填“是”或“否”)正确,其理由是___。
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是___。
(5)本实验苯甲醇的产率为___%(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y(足量)可能是( )
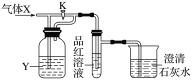
选项 | A | B | C | D |
X | CO | SO2 | CO2 | Cl2 |
Y | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式
(1)二氧化碳通入澄清石灰水_________________________________
(2)小苏打除胃酸___________________________________________
(3)硫酸和氢氧化钠反应_____________________________________
(4)金属铜和硝酸银溶液反应_________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com