
【题目】下图是一检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y(足量)可能是( )
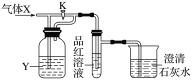
选项 | A | B | C | D |
X | CO | SO2 | CO2 | Cl2 |
Y | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。
(1)在标准状态下,由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成焓。各物质的标准摩尔生成焓如表:

则制备合成气的反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)在标准状态下的反应热ΔH=___kJ/mol。
2CO(g)+2H2(g)在标准状态下的反应热ΔH=___kJ/mol。
(2)在刚性容器中,当投料比![]() =1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
=1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
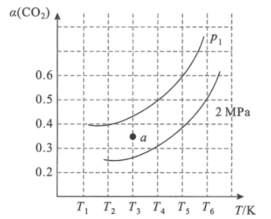
①由图可知:压强P1___2MPa(填“>”、“<”或“=”),理由是___。
②当温度为T3、压强为p1时,a点的v正___v逆(填“>”、“<”或“=”)。
③若起始时提高投料比![]() ,则CO2的平衡转化率将___(填“升高”或“降低”)。
,则CO2的平衡转化率将___(填“升高”或“降低”)。
④起始时向容器中加入1molCH4和1molCO2,在温度为T6。、初始压强为2MPa时反应,该反应的Kp=___(MPa)2。
(3)该催化重整过程中有副产物碳生成,碳的积累会严重影响催化剂的活性。某研究小组计算和模拟实验表明积碳量(催化剂表面碳的质量与催化剂的质量之比)与投料比、温度的关系如图。
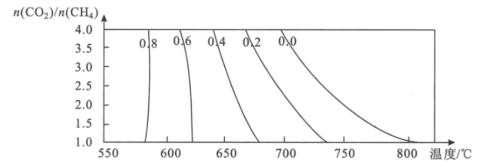
当投料比![]() =2.0时,要使积碳量最小,应调节温度为___℃。
=2.0时,要使积碳量最小,应调节温度为___℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为构成细胞的元素及化合物,a、b、c、d代表不同的小分子物质,A、B、C代表不同的大分子物质,下列说法正确的是( )

A.物质a是葡萄糖,检验物质a的常用试剂是双缩脲试剂。在动物细胞内,与物质A作用最相近的物质是糖原
B.若物质A在动物、植物细胞中均可含有,并且是细胞内最理想的储能物质,不仅含能量多而且体积较小,则A是脂肪
C.物质c在人体细胞中共有8种,分子中R基的不同决定了c的种类不同
D.物质d的元素组成与物质a的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在工农业生产及航天航空业中具有广泛的用途。回答下列问题:
⑴NF3为无色、无味的气体,可用于微电子工业,该物质在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为______,NF3在空气中泄漏时很容易被观察到,原因是_______。
⑵汽车尾气中催化剂可将NO、CO转化成无害气体。
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能/kJ·mol1 | 1076 | 630 | 945 | 803 |
2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH
①ΔH=______________________________kJ·mol1。
②该反应的平衡常数与外界因素X(代表温度、压强、![]() 或催化剂接触面)关系如下图所示。
或催化剂接触面)关系如下图所示。
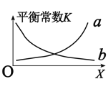
X是______,能正确表达平衡常数K随X变化的曲线是_______(填:a或b)。
⑶在一定温度和催化剂作用下,8NH3(g)+8NO(g)+2NO2(g)9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟时达到平衡时,c(NH3)=0.5mol·L1,c(NO2)=0.25mol·L1。
①n=_____;
②υ(NO)=______;
③NH3的平衡转化率为_________。
⑷用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将____________(填:增大、减小或不变)。阳极的电极反应式为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
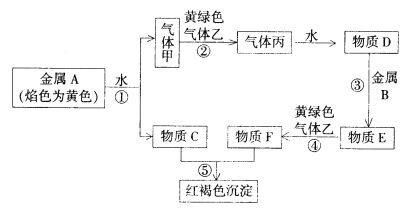
(1)A的原子结构示意图为_____________,丙的化学式为_____________。
(2)金属A、B和气体甲、乙、丙以及物质C、D、E、F中不能导电的有__________________ 、属于电解质的有___________ 。(填“A”“B”“甲”“乙”“丙”“C”“D”“E”“F”)
(3)写出转化①发生的化学方程式:____________________,写出转化④发生的离子方程式:____________________。
(4)将Na2O2投入到E溶液中,可以观察到的现象是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都是22.4L
B. 同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C. 在标准状况下,体积为22.4L的物质都是1mol
D. 在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法测室内甲醛含量的原理为:

已知:吸光度与溶液中有色物质的浓度成正比
下列说法正确的是
A. 反应①中参与反应的HCHO为30g时转移电子2mol
B. 可用双氧水检验反应②后的溶液中是否存在Fe3+
C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8mol
D. 理论上测得溶液吸光度越高,HCHO含量也越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制0.40mol·L-1 Na2CO3溶液100mL。
⑴请将配制该溶液的实验步骤补充完整。
①计算,需Na2CO3固体的质量为__________g;
②把称量好的Na2CO3固体倒入小烧杯中,加入适量的蒸馏水溶解、冷却至室温;
③把②所得溶液小心引流到100mL容量瓶中;
④继续向容量瓶中加蒸馏水至液面接近容量瓶的刻度线1~2cm处,改用胶头滴管滴加蒸馏水至______________________________________________;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒_________次,并将每次洗涤的溶液都注入容量瓶,轻轻摇匀;
⑥将容量瓶的瓶塞盖好,反复上下颠倒、摇匀。
⑵容量瓶使用前需____________________________________。
⑶配制该溶液的正确顺序是______________________________(填序号)。
⑷若出现如下情况,其中将引起所配溶液浓度偏低的是__________(填序号)。
①未洗涤烧杯内壁和玻璃棒
②定容时,俯视容量瓶的刻度线
③转移前,容量瓶中含有少量蒸馏水
④加水定容时不慎超过了刻度线,再用胶头滴管吸出多余的液体
⑸上述配制好的溶液导入试剂瓶后需贴上标签,请你填写如图标签的内容_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com