
【题目】氮的化合物在工农业生产及航天航空业中具有广泛的用途。回答下列问题:
⑴NF3为无色、无味的气体,可用于微电子工业,该物质在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为______,NF3在空气中泄漏时很容易被观察到,原因是_______。
⑵汽车尾气中催化剂可将NO、CO转化成无害气体。
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能/kJ·mol1 | 1076 | 630 | 945 | 803 |
2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH
①ΔH=______________________________kJ·mol1。
②该反应的平衡常数与外界因素X(代表温度、压强、![]() 或催化剂接触面)关系如下图所示。
或催化剂接触面)关系如下图所示。
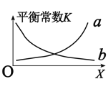
X是______,能正确表达平衡常数K随X变化的曲线是_______(填:a或b)。
⑶在一定温度和催化剂作用下,8NH3(g)+8NO(g)+2NO2(g)9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟时达到平衡时,c(NH3)=0.5mol·L1,c(NO2)=0.25mol·L1。
①n=_____;
②υ(NO)=______;
③NH3的平衡转化率为_________。
⑷用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将____________(填:增大、减小或不变)。阳极的电极反应式为______________。

【答案】2:1 NO与O2反应生成红棕色NO2 -745 温度 b 1.25 0.15mol·L1·min1 75% 增大 2CN--10e-+12OH-=2CO32-+N2↑+6H2O
【解析】
(1)NF3在潮湿的环境中易变质生成HF、NO、HNO3,该反应的方程式为3NF3+5H2O=2NO+HNO3+9HF,其中NO是还原产物,硝酸是氧化产物,则氧化剂与还原剂的物质的量之比为2:1。由于生成的NO与O2反应生成红棕色的NO2,所以NF3在空气中泄漏时很容易被观察到,故答案为:2:1;NO与O2反应生成红棕色的NO2;
(2)①结合图表中的数据,根据ΔH=反应物的总键能-生成物的总键能可得,ΔH=(630×2+1076×2-945-803×4)kJ·mol-1=-745 kJ·mol-1,故答案为:-745;
②平衡常数K只与温度有关,则X代表温度,由(1)可知,该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故曲线b符合平衡常数随温度的变化,故答案为:温度;b;
(3)由题干信息,设NH3转化的物质的量浓度为8xmol/L,列三段式有:
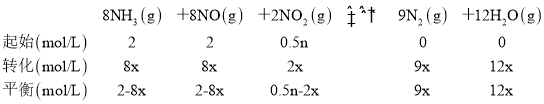
①已知经10分钟时达到平衡时,c(NH3)=0.5mol·L1,c(NO2)=0.25mol·L1,则2-8x=0.5,解得8x=1.5,则0.5n-2x=0.5n-0.375=0.25,解得n=1.25,故答案为:1.25;
②![]() ,故答案为:0.15mol·L1·min1;
,故答案为:0.15mol·L1·min1;
③NH3的平衡转化率![]() ,故答案为:75%;
,故答案为:75%;
(4)用电解法将工业废水中的CN-转变为N2,氮元素化合价从-3价升高到0价,碳元素化合价从+2价升高到+4价,发生氧化反应,所以装置左侧为阳极,右侧为阴极,根据电解原理可知,H+在阴极得电子发生还原反应,电极反应式为:2H2O+2e-===H2↑+2OH-,阴极有OH-生成,所以pH增大,在阳极,CN-将转变为N2和CO32-,氮元素化合价从-3价升高到0价,碳元素化合价从+2价升高到+4价,电极反应式为:2CN--10e-+12OH-===2CO32-+N2↑+6H2O,故答案为:增大;2CN--10e-+12OH-===2CO32-+N2↑+6H2O。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
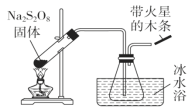
【题目】过硫酸钠(Na2S2O8)具有极强的氧化性,且不稳定,某化学兴趣小组探究过硫酸钠的相关性质,实验如下。已知SO3是无色易挥发的固体,熔点16.8℃,沸点44.8℃。
(1)稳定性探究(装置如图):
分解原理:2Na2S2O8![]() 2Na2SO4+2SO3↑+O2↑。
2Na2SO4+2SO3↑+O2↑。
此装置有明显错误之处,请改正:______________________,水槽冰水浴的目的是____________________;带火星的木条的现象_______________。
(2)过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为______________________,该反应的氧化剂是______________,氧化产物是________。
(3)向上述溶液中加入足量的BaCl2,过滤后对沉淀进行洗涤的操作是___________________________。
(4)可用H2C2O4溶液滴定产生的紫红色离子,取20mL待测液,消耗0.1mol·L-1的H2C2O4溶液30mL,则上述溶液中紫红色离子的浓度为______mol·L-1,若Na2S2O8有剩余,则测得的紫红色离子浓度将________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )

A.原子半径:Z>Y>X>W
B.氢化物的沸点:Y>X>Z>W
C.X的氧化物的水化物是强酸
D.Y的某种单质具有杀菌消毒作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲醇的反应原理和有关数据如图:
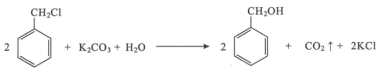
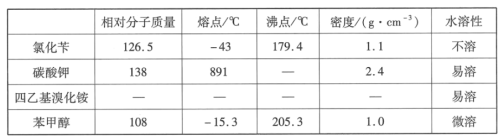
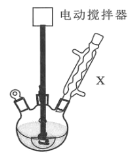
实验步骤:如图所示,在装有电动搅拌器的250mL三颈烧瓶里加入9.0g碳酸钾(过量),70.0mL水,加热溶解,再加入2.0mL四乙基溴化铵[(CH3CH2)4NBr]溶液和10.0mL氯化苄。搅拌加热回流反应1~1.5h。反应结束后冷却,并转入125mL分液漏斗中,分出有机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,收集200~208℃的馏分,得8.4mL苯甲醇。
回答下列问题:
(1)仪器X的名称是___,冷却水应从___(填“上口”或“下口”)通入。由于苯甲醇的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是___(填字母)。
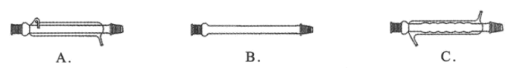
(2)本实验中加入无水硫酸镁的目的是___。从绿色化学角度考虑,萃取剂宜采用___(填字母)。
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法___(填“是”或“否”)正确,其理由是___。
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是___。
(5)本实验苯甲醇的产率为___%(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应 NO2+NH3→N2+H2O(未配平)制作下面装置图所示的电池,用以消除氮氧化物的污染。下列有关该电池说法一定正确的是 ( )

A.电极乙为电池负极
B.离子交换膜为质子交换膜
C.负极反应式为 2NH3-6e-+6OH-=N2↑+6H2O
D.28.0L(标准状况)NO2 完全被处理,转移 4mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y(足量)可能是( )
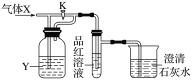
选项 | A | B | C | D |
X | CO | SO2 | CO2 | Cl2 |
Y | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)![]() 2B(g)+C(g)在恒压的密闭容器中反应,下列选项中不能说明反应已达到平衡状态的是( )
2B(g)+C(g)在恒压的密闭容器中反应,下列选项中不能说明反应已达到平衡状态的是( )
A. 容器内气体密度不再改变的状态
B. v(A):v(B):v(C)=2:2:1
C. c(A):c(B):c(C)的值保持不变
D. 混合气体的平均相对分子质量不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)是有机合成中常用的还原剂。一种制备硼氢化钠工艺如下(部分条件和产物省略):
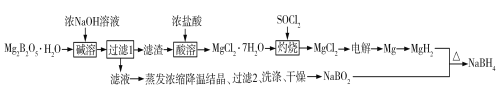
已知:MgH2、NaBH4遇水蒸气剧烈反应并放出H2。
回答下列问题:
(1)Mg2B2O5H2O中B的化合价为_______________。MgH2和NaBO2必须在干燥条件下合成硼氢化钠,其原因是_____________________________________________。
(2)难溶的Mg2B2O5与浓氢氧化钠溶液反应的离子方程式为__________。
(3)SOCl2溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧时加入SOCl2的目的是______________________________。
(4)已知镁—H2O2酸性燃料电池反应为Mg+H2O2+H2SO4![]() MgSO4+2H2O。常温下,电解质溶液为200 mL 0.1 mol·L1硫酸溶液。
MgSO4+2H2O。常温下,电解质溶液为200 mL 0.1 mol·L1硫酸溶液。
①写出正极的电极反应式:______________________________。
②若电路中有0.038 mol转移电子时,则溶液pH约为_____(忽略体积变化,不考虑H2O2电离)。
(5)“有效氢”是衡量含氢还原剂的还原能力指标,定义为1 g含氢还原剂的还原能力与多少克H2相当。NaBH4的“有效氢”等于_________________(结果保留2位小数)。
(6)工业上,可以利用NaBO2、HCHO和生石灰在加热下生成NaBH4和难溶的盐,写出化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,醋酸溶液中存在下述关系:Ka=c(H+)c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中Ka的数值是该温度下醋酸的电离平衡常数。有关Ka的下列说法正确的是( )
A. 当向该溶液中加入一定量的硫酸时,Ka的值增大
B. 升高温度,Ka的值增大
C. 向醋酸溶液中加水,Ka的值增大
D. 向醋酸溶液中加氢氧化钠溶液,Ka的值增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com