
����Ŀ���ۺ���������ˮ��������Ҫ�����������Ի����������![]() ��Ҫ�ɷ�ΪFe2O3��FeO��SiO2��
��Ҫ�ɷ�ΪFe2O3��FeO��SiO2��![]() Ϊԭ����ȡ�ۺ�������(Fe2(OH)x(SO4)(3-
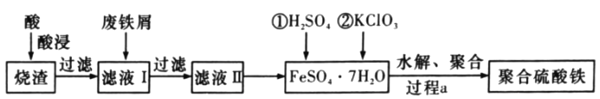
Ϊԭ����ȡ�ۺ�������(Fe2(OH)x(SO4)(3-![]() ))�Ĺ���������ͼ��ʾ��
))�Ĺ���������ͼ��ʾ��
(1)�������ʱ����ʵ�����______![]() д��ѧʽ
д��ѧʽ![]() ��
��
(2)�����������Һ����Ҫ�Ľ�����������______��
(3)����KClO3��Ŀ����______(������ӷ���ʽ˵��)��
(4)������a�������ɾۺ��������Ĺ�������ˮ���پۺϣ�������ˮ�ⷴӦԭ���Ļ�ѧ����ʽ����������Fe2(SO4)3+______H2O![]() ______Fe2(OH)x(SO4)(3-
______Fe2(OH)x(SO4)(3-![]() )+______��
)+______��
(5)�λ���B�Ǻ�������������Ч������Ҫָ�꣬ͨ���λ���Խ�ߣ�����Ч��Խ�á���֪�λ���B�ı���ʽΪB=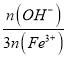 ��100%(nΪ���ʵ���
��100%(nΪ���ʵ���![]() ��Ϊ����ۺ����������λ��ȣ���������ʵ�������
��Ϊ����ۺ����������λ��ȣ���������ʵ�������
![]() ȡ�ۺ���������Ʒmg������������ᣬ��ַ�Ӧ���ټ�����к���ȴ������ˮ���ټ���KF��Һ����Fe3+��ʹFe3+����OH-��Ӧ��Ȼ���Է�̪Ϊָʾ������cmol/L�ı�NaOH��Һ�����к͵ζ������յ�ʱ����NaOH��ҺV0mL��
ȡ�ۺ���������Ʒmg������������ᣬ��ַ�Ӧ���ټ�����к���ȴ������ˮ���ټ���KF��Һ����Fe3+��ʹFe3+����OH-��Ӧ��Ȼ���Է�̪Ϊָʾ������cmol/L�ı�NaOH��Һ�����к͵ζ������յ�ʱ����NaOH��ҺV0mL��
![]() ���հԱ�ʵ�飺ȡ�벽��i�������Ũ�ȵ����ᣬ�Է�̪Ϊָʾ������cmol/L�ı�NaOH��Һ�����к͵ζ������յ�ʱ����NaOH��ҺVmL��
���հԱ�ʵ�飺ȡ�벽��i�������Ũ�ȵ����ᣬ�Է�̪Ϊָʾ������cmol/L�ı�NaOH��Һ�����к͵ζ������յ�ʱ����NaOH��ҺVmL��
�ٸþۺ���������Ʒ�У�n(OH-)=______mol��
����֪����Ʒ��Fe����������Ϊ![]() �����λ���B=______��
�������B=______��
���𰸡�H2SO4 Fe3+��Fe2+ ��Fe2+����ΪFe3+ ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O x 1 ![]() H2SO4 10-3cV0-10-3cV
H2SO4 10-3cV0-10-3cV ![]() ��100%
��100%
��������
�������������Ҫ�ɷ�ΪFe2O3��FeO��SiO2�ȣ��������м������ȡ�����Ʊ�Ŀ�Ŀ�֪���������Ϊϡ���ᣬFe2O3��FeO�ǽ����������ϡ���ᷴӦ�ֱ�õ�������������������SiO2��������������������ᣬ���˺�õ�����ҺI�к�������������������������ϡ���ᣬ����ҺI�м������м��Fe����������Ӧ�����������������˺�õ�����ҺII�к�����������������Һ����Ũ������ȴ�ᾧ�����˵õ��̷������̷��м���ϡ���ᡢ����أ�������Ӧ6H++ClO3-+6Fe2+=6Fe3++Cl-+3H2O��Ȼ����ˮ�⡢�ۺϷ�ӦFe2(SO4)3+xH2O![]() Fe2(OH)x(SO4)(3-
Fe2(OH)x(SO4)(3-![]() )+
)+![]() H2SO4���Դ˽����⡣
H2SO4���Դ˽����⡣
(1)ͨ�����Ϸ���֪���������ΪH2SO4��
(2)��������Һ�к�������������������������ϡ���ᣬ���Ժ��е���������Fe3+��Fe2+��H+�����еĽ���������ΪFe3+��Fe2+��
(3)����ؾ���ǿ�����ԣ������������������������Ӷ���ȡ�ۺ����������ص������ǽ�Fe2+����ΪFe3+���漰�ķ���ʽΪ6H++ClO3-+6Fe2+=6Fe3++Cl-+3H2O��
(4)����Ԫ���غ㣬�÷�Ӧ����ʽΪFe2(SO4)3+xH2O![]() Fe2(OH)x(SO4)(3-
Fe2(OH)x(SO4)(3-![]() )+
)+![]() H2SO4���ʿ���ֱ���x��1��
H2SO4���ʿ���ֱ���x��1��![]() H2SO4��
H2SO4��
(5)��n(OH-)=cmol/L��10-3V0L-cmol/L��10-3VL=10-3c(V0-V)mol��
�ڸ���Ʒ��Fe����������w����n(Fe)=![]() mol���λ���B=
mol�����B= ��100%=
��100%=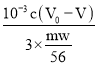 ��100%=
��100%=![]() ��100%��
��100%��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ�50mL 0.50mol/L������50mL 0.55mol/LNaOH��Һ��ͼʾ��װ���н����кͷ�Ӧ���ش��������⣺
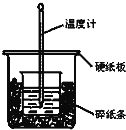
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ���������___________��
��2�����ձ����������Ӳֽ�壬��õ��к�����ֵ__________������ƫ��������ƫС��������Ӱ��������
��3��ʵ���и���60mL 0.50mol/L�����50mL 0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ������к���________�������������������������������ɣ�______________________��
��4��������Һ���ܶȶ���1g/mL���кͺ�������Һ�ı�����c=4.18J/��g���棩������ƽ�в��������ֹ�¶�����ʼ�¶Ȳt2��t1���ֱ�Ϊ����3.2�� ��2.2�� ��3.0�棬д����ʾ������NaOH��Һ��Ӧ���к��ȵ��Ȼ�ѧ����ʽ________________________����С�������һλС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽��������������ʵĹ�����,���и���ʵ������ó��Ľ��۲���ȷ����( )
A. �����а������Թܵ�����ˮ����,Һ��Ѹ�ٳ����Թ�,˵��������������ˮ
B. ��pH=11�İ�ˮϡ��1000��,���pH>8��˵��NH3��H2OΪ����
C. ����NH4HCO3����,�۲쵽��������,�Թܿ���Һ�β���,˵��NH4HCO3���Ȳ��ȶ�
D. �����ȵ�Pt˿������ͼ��ʾ����ƿ��,ƿ�ڳ�����������ɫ����,˵����������������ΪNO2
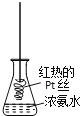
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ A �ǵ���,A��B��C��D��E �������ʾ���ͬһ��Ԫ��,X �ǵؿ��к�������Ԫ���γɵĵ��ʣ��ת����ϵ��ͼ��ʾ.�ش���������:

(1)ͨ�������,��AΪ����,C��D���Ǵ�����Ⱦ��;
��д�����з�Ӧ�Ļ�ѧ����ʽ
B![]() C_________________
C_________________
E![]() C_________________
C_________________
��ʵ�����м���B�IJ���������_________________��
�۱�״����,��ʢ��D���Թܵ�����ʢ��ˮ��ˮ����,һ��ʱ���,�ٶ����ʲ���ɢ,���Թ���������Һ�����ʵ���Ũ��Ϊ____________��
(2)ͨ�������,��AΪ����ɫ���壺
��д��B��C��Ӧ�Ļ�ѧ����ʽ��_______________________��
�ڽ�Cͨ����ˮ�е�������______��������Ӧ�����ӷ���ʽ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ������SiO2 ��̼��Ӧ����ȡ�裬д����Ӧ�Ļ�ѧ����ʽ___________________��
��ҵ�ϻ���������þ��ȡ�裬��ӦΪ2Mg+SiO2 = 2MgO+Si��ͬʱ�ᷢ������Ӧ��2Mg + Si = Mg2Si����ͼ�ǽ���Mg��SiO2��Ӧ��ʵ��װ�ã��Իش��������⣺

��1������O2��H2O��g���Ĵ��ڶԸ�ʵ���нϴ�Ӱ�죬ʵ����Ӧͨ������X��Ϊ���������Թ��еĹ���ҩƷ��ѡ��________(�����)��
a��ʯ��ʯ������b��п��������c������
��2��ʵ�鿪ʼʱ��������ͨһ��ʱ��X���壬�ټ��ȷ�Ӧ��������� ___________________________������Ӧ���������߾ƾ��ƣ���Ӧ�ܼ������У���ԭ����______________________��
��3����Ӧ��������ȴ������ʱ������Ӧ��Ļ�����м���ϡ���ᣬ�ɹ۲쵽�����Ļ��ǣ������������ԭ���Ǹ�����Mg2Si������Ѹ�ٷ�Ӧ����SiH4�����飩���壬Ȼ��SiH4��ȼ���û�ѧ����ʽ��ʾ��������Ӧ��________________________��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)��5O2(g) ![]() 4NO(g)��6H2O(g)������������ȷ����(����)
4NO(g)��6H2O(g)������������ȷ����(����)
A. �ﵽ��ѧƽ��ʱ4v��(O2)��5v��(NO)
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ��2v��(NH3)��3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��Q��E����Ԫ�ص�ԭ������������������Xԭ�Ӻ��������6�ֲ�ͬ���˶�״̬��s�ܼ���������p�ܼ���������������Zԭ��L������2�ԳɶԵ��ӣ�Q�ǵ��������е縺������Ԫ�أ�E�ĵ����dz�����Ψһ��Һ̬�ķǽ�������ش��������⣺
��1��X��Y��Z��һ��������С�����˳��Ϊ__________����Ԫ�ط��ţ���Y���⻯��ķ��ӿռ乹����_______��������ԭ�Ӳ�ȡ_____�ӻ�����__________�����������������Ǽ����������ӡ�
��2��EԪ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ_______________________________��
��3��XZ2�������________��������
��4��Z�⻯��ķе��Q�⻯��ķе�ߣ�������____________________________��
��5��XԪ�ؿ��γ�X60���ʣ���������ز�����һ��������һ�ָ���ϩ������侧����ͼ��ʾ������λ������������ĺͶ��㣬С����λ������������ϣ����û�������X60���ԭ�Ӹ�����Ϊ___________��
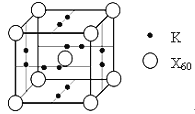
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pC������pH����ָ��ϡ��Һ������Ũ�ȵĸ���������������H2CO3��Һ����εμ�NaOH��Һ�������Һ��pC��pH��ϵ��ͼ��ʾ������˵��������ǣ� ��
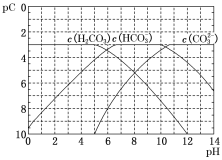
A.��ͬһ��Һ�У�H2CO3��HCO3�C��CO32�C���ܴ�������
B.H2CO3��������ƽ�ⳣ��Ka2������������10�C11
C.��pH=7ʱ����Һ��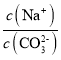 ��3
��3
D.��H2CO3��Һ�μ�NaOH��Һ����Һ�����ԵĹ����У�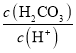 ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��Ӧ���̵������仯��ͼ��ʾ����ش��������⣺
��Ӧ���̵������仯��ͼ��ʾ����ش��������⣺
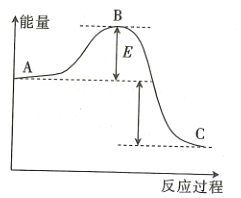
(1)�÷�Ӧ��______________��������������������������Ӧ��
(2)��![]() ���÷�Ӧ�Ĵ�����A��C������������Ƿ�仯?_____________�������仯����������������������____________________��
���÷�Ӧ�Ĵ�����A��C������������Ƿ�仯?_____________�������仯����������������������____________________��
(3)�����Ϊ2L�ĺ����ܱ�������ͨ��2mol![]() ��3mol
��3mol![]() ����������Ӧ��10min��
����������Ӧ��10min��![]() �����ʵ����仯���±���
�����ʵ����仯���±���
��Ӧʱ�䣨min�� | 0 | 3 | 5 | 7 | 10 |
| 0 | 0.2 | 0.3 | 0.38 | 0.38 |
�������¶ȣ���Ӧ����______________������������������С������
��������Ӧ��7minʱ_______________�������ﵽ������δ�ﵽ����ƽ��״̬��
��![]() min�ڣ���
min�ڣ���![]() ��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ_______________mol��L-1��min-1��
��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ_______________mol��L-1��min-1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com