
【题目】已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为__________(填元素符号)。Y的氢化物的分子空间构型是_______。其中心原子采取_____杂化,属__________(填“极性”或“非极性”)分子。
(2)E元素基态原子的电子排布式为_______________________________。
(3)XZ2分子中含有________个π键。
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是____________________________。
(5)X元素可形成X60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X60与钾原子个数比为___________。
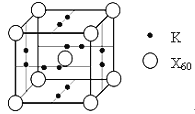
【答案】C<O<N 三角锥 sp3 极性 1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5; 2 水分子之间存在氢键,导致熔沸点升高 1:3
【解析】
X原子核外有6种不同的运动状态,说明核外有6个电子,推出X为C,Z原子L层上有2对成对电子,电子排布式应是1s22s22p4,推出Z为O,原子序数依次增大,推出Y为N,Q是第三周期电负性最大的元素,根据同周期电负性的规律,推出Q为Cl,E的单质是常温下唯一呈液态的非金属,推出E为Br;据以上分析解答相关问题。
(1)第一电离能的规律:同周期从左向右第一电离能增大,但是ⅡA族大于ⅢA,ⅤA族大于ⅥA族,推出N>O>C;Y的氢化物是NH3,中心原子N有3个δ键,1个孤电子对,价层电子对数为4,空间构型为:三角锥,杂化轨道数等于价层电子对数,则N为sp3杂化,属于极性分子;
(2)E为Br,属于第四周期ⅦA族元素,根据核外电子排布规律和泡利原理,核外电子排布式:1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5;
(3)XZ2的分子式CO2,属于共价化合物,其结构简式:O=C=O,1个双键之间有1个π键,因此CO2分子中有2个π键;
(4)Z的氢化物是H2O,Q的氢化物是HCl,H2O中存在分子间氢键,使H2O的沸点增加,而HCl中不含氢键,所以水的沸点大;
(5)根据均摊法,晶胞中C60的个数![]() +1=2,K的个数
+1=2,K的个数![]() =6,所以原子个数比2:6=1:3。
=6,所以原子个数比2:6=1:3。


科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A. ①中还需要进行过滤操作,滤渣为二氧化硅
B. a、b中铝元素的存在形式不同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题20图-1所示:
① a反应中每生成1molFeSO4转移电子的物质的量为___mol。
② d反应的离子方程式为_______________。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题20图-2
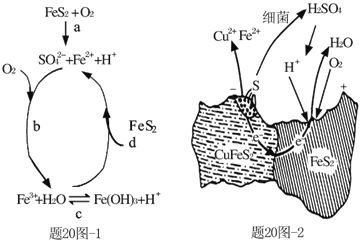
①冶炼过程中,正极周围溶液的pH___(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为___。
这里,否则就错了!!阅后删除! |
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
相关反应 | 反应热 | 平衡常数K |
FeS2(s) + H2(g) | ΔH1 | K1 |
1/2 FeS2(s) + H2(g) | ΔH2 | K2 |
FeS(s) + H2(g) | ΔH3 | K3 |
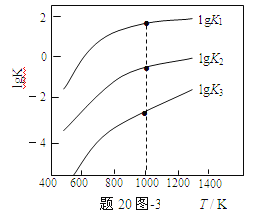
①上述反应中,ΔH1___0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有___(举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁是水处理中重要的絮凝剂。以黄铁矿的烧渣![]() 主要成分为Fe2O3、FeO、SiO2等
主要成分为Fe2O3、FeO、SiO2等![]() 为原料制取聚合硫酸铁(Fe2(OH)x(SO4)(3-
为原料制取聚合硫酸铁(Fe2(OH)x(SO4)(3-![]() ))的工艺流程如图所示:
))的工艺流程如图所示:
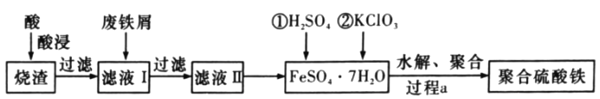
(1)“酸浸”时最合适的酸是______![]() 写化学式
写化学式![]() 。
。
(2)“酸浸”后溶液中主要的金属阳离子有______。
(3)加入KClO3的目的是______(结合离子方程式说明)。
(4)“过程a”中生成聚合硫酸铁的过程是先水解再聚合,将下列水解反应原理的化学方程式补充完整。Fe2(SO4)3+______H2O![]() ______Fe2(OH)x(SO4)(3-
______Fe2(OH)x(SO4)(3-![]() )+______。
)+______。
(5)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。已知盐基度B的表达式为B=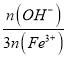 ×100%(n为物质的量
×100%(n为物质的量![]() 。为测出聚合硫酸铁的盐基度,进行如下实验操作:
。为测出聚合硫酸铁的盐基度,进行如下实验操作:
![]() 取聚合硫酸铁样品mg,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应,然后以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0mL。
取聚合硫酸铁样品mg,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应,然后以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0mL。
![]() 做空白对比实验:取与步骤i等体积等浓度的盐酸,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液VmL。
做空白对比实验:取与步骤i等体积等浓度的盐酸,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液VmL。
①该聚合硫酸铁样品中,n(OH-)=______mol。
②已知该样品中Fe的质量分数为![]() ,则盐基度B=______。
,则盐基度B=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
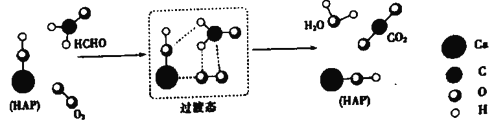
【题目】某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如下:
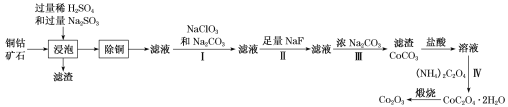
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的化学方程式:________。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=________。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3反应的离子方程式为_______。
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(CO2+)为0.1molL–1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为_____。[当c(Mn+)≤10–6 molL–1,即认为该金属离子沉淀完全]

(4)步骤II中加入足量NaF的目的是________。
(5)过滤出的CoC2O42H2O固体经洗涤后,证明固体已洗净的操作为________。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g) ![]() N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度,平衡常数减小 | 0~3 s内,反应速率为:v(NO2)=0.2 mol·L-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬的化合物在医药、材料领域有重要作用,认识铬及其化合物有重要意义。
(1)基态铬原子中,电子占据的最高能级符号为_____________。
(2)研究表明,当化合物的阳离子有未成对电子时,该化合物具有磁性。下列物质可用作录音带磁粉的是__________。
A.V2O5 B.Fe2O3 C.ZnO D.CrO2
(3)已知Cr3+在水溶液中的存在形式为[Cr(H2O)6]3+。在不同条件下,可从CrCl3水溶液中获得紫色、蓝绿色或绿色等不同颜色的配合物,其实验式均为CrCl36H2O。现取蓝绿色配合物0.1mol,加入足量AgNO3溶液,经过滤、洗涤、干燥得28.7g沉淀,则该化合物中的化学键类型有___________,写出该蓝绿色配合物的电离方程式:________。
(4)常温下,氯化酰铬(CrO2Cl2)是暗红色液体,能与CCl4、CS2等有机溶剂互溶。
①固体氯化酰铬属于______(填“极性”或“非极性”)分子,判断依据是______。
②等电子体是具有相同的价电子数和原子数的分子或离子。写出一种与CCl4分子互为等电子体的阴离子:_______(填化学式);写出CS2分子的电子式:____________。
(5)氮化铬(CrN)在超级电容器领域有良好应用前景,其晶体结构类型与氯化钠相同。
①氮化铬的熔点比氯化钠高的主要原因是______。
②与Cr3+次邻近的N3–有________个。
③已知Cr3+和N3–半径分别为apm、bpm,设Cr3+和N3–都是紧密接触的刚性小球,NA代表阿伏加德罗常数的值,晶体的密度为ρgcm–3,则CrN的摩尔质量为______。(用含a、b、NA、ρ的算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
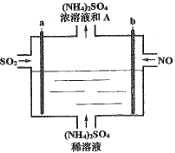
A.每处理lmol NO可以生成2mol A
B.a与电源负极相连,发生还原反应
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2∶5通入装置可彻底转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com