
【题目】在体积为2L的密闭容器中发生2SO2+O2 ![]() 2SO3反应,现控制下列三种不同的条件:①在400℃时,10molSO2与5molO2反应;②在400℃时,20molSO2与5molO2反应;③在300℃时,10molSO2与5molO2反应;
2SO3反应,现控制下列三种不同的条件:①在400℃时,10molSO2与5molO2反应;②在400℃时,20molSO2与5molO2反应;③在300℃时,10molSO2与5molO2反应;
(1)开始时正反应速率最快的是_________。
(2)若10min内测得第①组的平均反应速率为:V(SO2)=0.4mol/(L·min),则10min时,生成的SO3浓度为_________________。
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】(1)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2===4CuSO4+2H2O,该反应的还原剂是________________。当1 mol O2发生反应时,还原剂所失电子的物质的量为_________mol。
(2)焙烧明矾的化学方程式为4KAl(SO4)2·12H2O+3S===2K2SO4+2Al2O3+9SO2+48H2O,在该反应中,还原剂是_____________。
(3)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________。
(4)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
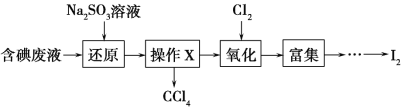
向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_________________;该操作将I2还原为I-的目的是________________________。
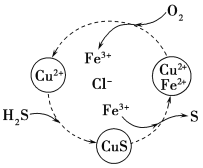
(5)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是________________。
(6)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为________________,反应消耗1 mol NaBH4时转移的电子数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如下图所示装置进行有关实验。
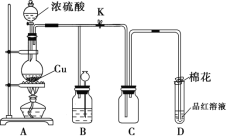
(1)装置A中发生反应的化学方程式为_________________________________________;
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是________________,B中应放置的溶液是________(填字母);
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(3)若装置C中盛有酸性KMnO4溶液,反应现象为_____________________,体现该气体的_____________(填“氧化性”或“还原性”);
(4)装置D中试管口放置的棉花应浸一种溶液,这种溶液是_____________,其作用是___________;
(5)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,反应完毕时,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
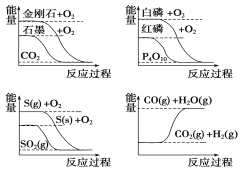
A. 白磷比红磷稳定
B. S(g)+O2(g)===SO2(g) ΔH1,S(s)+O2(g)===SO2(g) ΔH2,则ΔH1>ΔH2
C. CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
D. 石墨转变为金刚石是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在210℃达到平衡:
PCl5(g)![]() PCl3(g)+Cl2(g) △H >0 K=1 ①
PCl3(g)+Cl2(g) △H >0 K=1 ①
CO(g)+Cl2(g)![]() COCl2(g) △H <0 K=5×104 ②
COCl2(g) △H <0 K=5×104 ②
COCl2(g)![]() CO(g)+ Cl2(g) △H >0 ③
CO(g)+ Cl2(g) △H >0 ③
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示____________,K值大小与温度的关系是:温度升高,K值___________________(填一定增大、一定减小、或可能增大也可能减小)。
(2)根据反应①的平衡常数K的表达式,平衡时,下列等式必定成立的是___________
A.c(PCl5) = c(PCl3)= c(Cl2)=1
B.c(PCl5)= c(PCl3)·c(Cl2)=1
C.c(PCl5)= c(PCl3)·c(Cl2)
(3)降低Cl2浓度,反应③的K值___________(填“增大”、“减少”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列有关说法错误的是( )
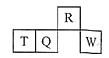
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. T的单质是两性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是一个四肽,它可看作是4个氨基酸缩合掉3分子水而得,![]() ,式中的R,R′、R″、R可能是相同的或不同的烃基或有取代基的烃基.﹣NH﹣CO﹣称为肽键,今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:
,式中的R,R′、R″、R可能是相同的或不同的烃基或有取代基的烃基.﹣NH﹣CO﹣称为肽键,今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:

问:
(1)这个“多肽”是_________肽;
(2)该多肽水解后,有_________个谷氨酸;
(3)该多肽水解后,有_________个苯丙氨酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:

(1)装置应盛放的试剂是I ____,IV _______(将下列有关试剂的序号填入空格内);
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是____________________________;
(3)使用装置II的目的是____________________________________ ;
(4)使用装置III的目的是 ___________________________________;
(5)确定含有乙烯的现象是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com