
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知氧化还原反应反应 K2Cr2O7 + 14HCl![]() == 2KCl + 2CrCl3 + 3Cl2+ 7H2O。关于该反应的说法中正确的组合是
== 2KCl + 2CrCl3 + 3Cl2+ 7H2O。关于该反应的说法中正确的组合是
①氧化剂是K2Cr2O7②还原性:Cl->Cr3+③每生成1molCl2,电子转移为6mol④CrCl3是氧化产物
A. ①② B. ①②④ C. ①③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氯化铵受热固体消失和干冰升华只需克服分子间作用力
B. NaF、H2SO4中所含化学键类型相同
C. I2、Br2、Cl2、F2熔沸点逐渐升高
D. HCl气体溶于水和NaOH熔化破坏的化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:___与盐酸反应最剧烈,_____与盐酸反应产生的气体最多。(填元素符号)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:__。
Ⅱ.利用图装置可验证同主族元素非金属性的变化规律
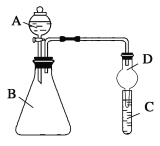
(3)仪器A的名称为____。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉—碘化钾混合溶液,观察到C中溶液____现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液_____的现象,反应的离子方程为: _____。有同学认为实验无法证明C非金属性大于Si,请指出实验设计的不足之处,并进行改进: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的密闭容器中发生2SO2+O2 ![]() 2SO3反应,现控制下列三种不同的条件:①在400℃时,10molSO2与5molO2反应;②在400℃时,20molSO2与5molO2反应;③在300℃时,10molSO2与5molO2反应;
2SO3反应,现控制下列三种不同的条件:①在400℃时,10molSO2与5molO2反应;②在400℃时,20molSO2与5molO2反应;③在300℃时,10molSO2与5molO2反应;
(1)开始时正反应速率最快的是_________。
(2)若10min内测得第①组的平均反应速率为:V(SO2)=0.4mol/(L·min),则10min时,生成的SO3浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.CO2与SiO2都能跟H2O反应生成相应的酸
B.SiO2与CO2都不能与酸反应
C.SiO2与CO2都能够与氢氧化钠溶液反应
D.水晶的主要成分是SiC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L醋酸溶液加水稀释,下列说法正确的是
A. 溶液中c(OH+)和c(OH-)都减小B. 溶液中c(OH+)增大
C. 醋酸电离平衡向左移动D. 溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2 mol某烃A在氧气中充分燃烧后,生成化合物B,C各1.2 mol。试回答:
(1)烃A的分子式为________。
(2)若取一定量的烃A完全燃烧后,生成B、C各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气________L。
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为________________________________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为____________________________________;比烃A少2个碳原子的同系物有________种同分异构体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com