
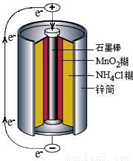
 锌锰干电池中含NH4Cl淀粉糊(电糊)、Mn02、炭粉和锌筒(含锌、铁和铜 等)等物质(如图).
锌锰干电池中含NH4Cl淀粉糊(电糊)、Mn02、炭粉和锌筒(含锌、铁和铜 等)等物质(如图).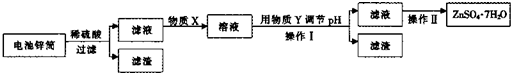
| 氢氧化物 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.7 | 8.1 | 7.6 | 6.5 | 4.7 |
| 完全沉淀的pH | 3.7 | 10.1 | 9.6 | 8.0 | 6.5 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量. | 生成白色沉淀, 白色沉淀逐渐溶解,产生刺激性气味的气体 白色沉淀逐渐溶解,产生刺激性气味的气体 |
无色溶液中 存在Zn2+离子 |
| ② 将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口 将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口 |
红色石蕊试纸变蓝 红色石蕊试纸变蓝 |
无色溶液中 存在NH4+离子 |
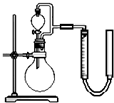
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2 和稀硫酸 |
黑色粉末部分溶解, 收集到112mL气体 |
MnO2做氧化剂 MnO2做氧化剂 生成Mn2+离子 生成Mn2+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
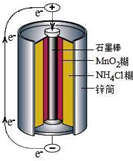
 锌锰干电池是最早使用的化学电池,其基本构造如图所示.
锌锰干电池是最早使用的化学电池,其基本构造如图所示.| 实验步骤 | 实验现象 | 实验结论和解释 | ||||||||
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, 白色沉淀消失, 白色沉淀消失, 产生有刺激性气味的气体 产生有刺激性气味的气体 |
无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 NH4++OH-
NH4++OH-
|

| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 |
MnO2做氧化剂,生成Mn2+离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ |
无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 |
MnO2做氧化剂,生成Mn2+离子 |
查看答案和解析>>
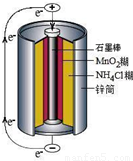
科目:高中化学 来源:2009-2010学年北京市西城区高一(下)期末化学试卷(解析版) 题型:解答题
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省黄冈市高一(下)期末化学试卷(解析版) 题型:解答题
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com