
����Ŀ���⻯ﮣ�LiH���ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�ա�ij�С����ʹ������װ���Ʊ�LiH���塣
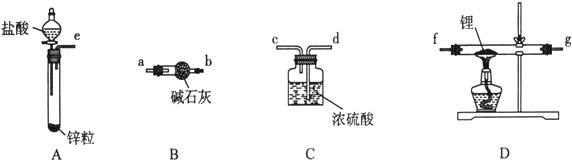
��ͬѧ��ʵ�鷽�����£�
��1����������װ���ӣ���������װ�ð���������������˳��Ϊ________________������ҩƷǰ����Ҫ���е�ʵ�������____________������д������IJ���������������װ��B��������___________��
��2������ҩƷ�������Ӵ��Լ�ƿ��ȡ��һ��������ﮣ�����ʯ���ܷ⣩��Ȼ���ڼױ��н�ϴ���Σ��ò�����Ŀ����____________________��Ȼ����ٰ�﮷��뵽ʯӢ���С�
��3��ͨ��һ��ʱ�����������ʯӢ�ܣ�ͨ������������___________________________���ڼ���D����ʯӢ��֮ǰ��������е�ʵ�������__________��
��4������һ��ʱ���ֹͣ���ȣ�����ͨ������ȴ��Ȼ��ȡ��LiH��װ�뵪���ƿ������ڰ�������ȡ����������Ŀ����Ϊ�˱���LiH������е�ˮ�����Ӵ�������Σ�գ���Ӧ����ʽΪ_____________��
��5��ȷ�����ƵõIJ�Ʒ0.174g����һ��������������ˮ��Ӧ���ռ�������470.4 mL���ѻ���ɱ�״���������Ʒ��LiH��Li�����ʵ���֮��Ϊ____________________��
���𰸡� e��a��b��f��g��d��c ��f��g����Ҳ���ԣ� ����װ�õ������� ��ȥH2�е�H2O��HCl ��ȥﮱ����ʯ�� ����װ���п�������ֹ����ʱﮡ�������������Ӧ��������ը �ռ�c���ų������岢����H2���� LiH + H2O = LiOH + H2�� 10��1
���������������ɸ�װ�õ��ص�����ƶ�����ͬѧ��ʵ�鷽��Ϊ���£���Aװ����п�������Ʊ�����������������һ������H2O��HCl��������B�ü�ʯ�ҳ�ȥH2�е�H2O��HCl��ͨ��D���ų�ϵͳ�ڵĿ������������Ĵ��ȣ�Ȼ�����D�в������Ʊ�LiH��Cװ����Ϊ�˷�ֹ�����е�ˮ��������D������ֹ�⻯ﮣ�LiH����ˮ����ȼ�ա�
��⣺��1����������װ���ӣ���������װ�ð���������������˳��Ϊe��a��b��f��g��d��c ��f��g����Ҳ���ԣ�������ҩƷǰ����Ҫ���е�ʵ������Ǽ���װ�õ������ԣ�����װ��B�������dz�ȥH2�е�H2O��HCl��
��2�������Ӵ��Լ�ƿ��ȡ��һ��������ﮣ�����ʯ���ܷ⣩��Ȼ���ڼױ��н�ϴ���Σ�������������ԭ����֪��ʯ�������ڱ����ʸò�����Ŀ���dz�ȥﮱ����ʯ����
��3��ͨ��һ��ʱ�����������ʯӢ�ܣ�ͨ�����������Ǹ���װ���п�������ֹ����ʱﮡ�������������Ӧ��������ը���ڼ���D����ʯӢ��֮ǰ��������е�ʵ��������ռ�c���ų������岢����H2������
��4������һ��ʱ���ֹͣ���ȣ�����ͨ������ȴ��Ȼ��ȡ��LiH��װ�뵪���ƿ������ڰ�������ȡ����������Ŀ����Ϊ�˱���LiH������е�ˮ�����Ӵ�������Σ�գ���Ӧ����ʽΪLiH + H2O = LiOH + H2����
��5��ȷ�����ƵõIJ�Ʒ0.174g����һ��������������ˮ��Ӧ���ռ�������470.4 mL���ѻ���ɱ�״��������n(H2)=![]() ����n(LiH)
����n(LiH)![]() ��n(H2)=n(LiH)+0.5
��n(H2)=n(LiH)+0.5![]() ����֮��n(LiH)=0.02mol��
����֮��n(LiH)=0.02mol��![]() �����ԣ���Ʒ��LiH��Li�����ʵ���֮��Ϊ10��1��
�����ԣ���Ʒ��LiH��Li�����ʵ���֮��Ϊ10��1��


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ֹ��廯����X�����������磬���ۻ�״̬������ˮ���ܹ����룬���й��ڸû�����X��˵������ȷ���ǣ�������
A.Xһ���ǵ����
B.X�����Ƿǵ����
C.Xֻ������
D.X�������κλ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ģ���������е�ԭ��(���������볱ʪ������̼��Ӧ)���������ͼ��ʾ����������ȡ���������������������ͼ��EΪ����װ�á�

��ʵ��ɹ�ѡ�õ�ҩƷ���У�ϡ���ᡢϡ���ᡢ�������ơ�����ʯ��ˮ��
�Իش�
(1)ͼ��װ�õ�����˳����(��װ�õ���ĸ���)���������ӽ��ܼ�֧��װ��ʡ�ԣ�_________��
(2)װ��C�з���ķ�Ӧ����________��_________________��(д��ѧʽ)
(3)װ��A��������__________________��װ��B��������_______________��
(4)װ��D�з����Ļ�ѧ��Ӧ����ʽΪ__________________________��
(5)Ϊ�˽�ȷ�ز�����������������˱���������װ�õ�������֮�⣬�ڶ���Ӧǰ�����Һ��Ķ��������ֵ�Ĺ����У�Ӧע��_____________��
a.�����밼Һ����ʹ���ƽ
b.�ȴ�Ƭ�̣����ҹ���Һ�治������ʱ�����̶�����
c.����ʱӦ�����ƶ��ҹܣ�ʹ�ס�������Һ����ƽ��
d.����ʱ��һ��ʹ�ס�������Һ����ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʱ����ɫ��ӦΪ��ɫ�������ж���ȷ���ǣ� ��
A.������һ������Ԫ�أ�����ȷ���Ƿ���KԪ��
B.������һ���ǽ�����
C.������һ��ֻ����Ԫ��
D.������һ�����ƵĻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(14��)��֪���Ȼ������۵�Ϊ306�����е�Ϊ315����������ˮ������ǿ�ҵ���ˮ��,�����տ������ˮ�ֶ����⡣ijѧϰС���ͬѧ�����������ķ�Ӧ��������������̽��ʵ�飺
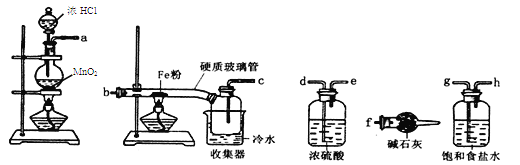
��1��װ�õ�����˳��Ϊ ��
��2������ʳ��ˮ�������� ��
��3����Ӧһ��ʱ���Ϩ��ƾ��ƣ���ȴ��Ӳ�ʲ����ܼ��ռ����е�����һ������ת������ƿ�У����������ϡ���������ֲ����(��Ӧ�����в���)����ַ�Ӧ��������ʵ�飺
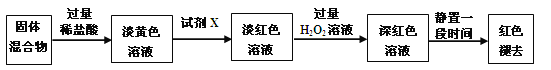
������ɫ��Һ�м����Լ�X���ɵ���ɫ��Һ�����ӷ�Ӧ����ʽΪ_______��
������ɫ��Һ�м������H2O2����Һ��ɫ�����ԭ���� ��
��4����֪��ɫ��ȥ��ͬʱ���������ɣ�������ΪO2����С��ͬѧ�Ժ�ɫ��ȥ��ԭ�����̽����
��ȡ��ɫ����Һ���ݣ���һ�ݵμ�FeCl3��Һ�����Ա仯���ڶ��ݵμ��Լ�X����Һ���ֺ�ɫ�������ݵμ�ϡHCl��BaCl2��Һ��������ɫ������
����ȡͬŨ�ȵ�FeCl3��Һ�μ�2���Լ�X����Һ��죬��ͨ��O2�������Ա仯��
ʵ����˵�� ��
ʵ������Ŀ���� ��
�ó����ۣ���Һ��ɫ��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ����ϵ��aA(g)+bB(g)![]() cC(g)+dD(g) ��H<0�������ж����в���ȷ����
cC(g)+dD(g) ��H<0�������ж����в���ȷ����
A. ���¶Ȳ��䣬�����������һ������ʱA��Ũ����ԭ����0.45������a+b<c+d
B. ��������Ӧ��ʼ��ƽ��ʱ��A��B��ת������ȣ���Ͷ��A��B�����ʵ���֮��Ϊa:b
C. ��ƽ����ϵ�й�������Mmol���������г���bmolB���ﵽƽ��ʱ���������ʵ���Ϊ( M+b)mol����a+b=c+d
D. ��a+b=c+d�������������������������¶ȣ�ƽ�������ƶ��������������ѹǿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������;�㷺������������Ҫ�ɷ�ΪAl2O3��nH2O������SiO2��Fe2O3����ȡAl������;����
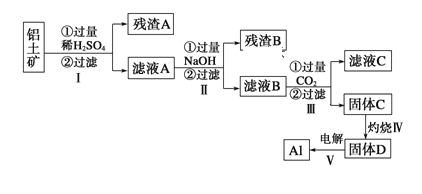
��1����ҺA�ӹ���NaOH���ӷ���ʽ��ʾΪ______________________________
��2������ʱʢ��ҩƷ������������_______
��3��������з�����Ӧ�Ļ�ѧ����ʽ��___________________________________
��4������������ɹ���C�����ӷ�Ӧ����ʽΪ_____________________________
��5��ȡ��ҺB 100mL������1 mol/L����200 mL���������ﵽ���������Ϊ11��7g������ҺB��c��AlO2����____mol/L��c��Na+��____6 mol/L ������ڡ�����С�ڡ����ڡ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ú����۷���V2O3��Ϊ����ijʯúΪԭ�ϣ�����Al2O3��CaO�����ʣ����ƻ��������Ʊ�V2O5�����������£�
![]()
����������+5�۷�����Һ�е���Ҫ������ʽ����ҺpH�Ĺ�ϵ��
pH | 4~6 | 6~8 | 8~10 | 10~12 |
��Ҫ���� | VO2+ | VO3 | V2O74 | VO43 |
��1�����գ���ʯú�м���ʯ�ұ�������V2O3ת��ΪCa(VO3)2�Ļ�ѧ����ʽ��______��
��2������� �� Ca(VO3)2������ˮ�����������ᡣ����ɰ���ʱ��Һ��pH��4��Ca(VO3)2������������ӷ���ʽ��______��
�� ��ȶԷ��������ܽ�����Ӱ����ͼ��ʾ�����ʱ��Һ����ȿ����ڴ�Լ3.2%��������ͼ�Ʋ������ʱ��ѡ�������ȵ�ԭ����______��

��3��ת����������Һ�еķ�ת��ΪNH4VO3���壬���������£�
![]()
�� ����Һ�м���ʯ�����������______��
�� ��֪CaCO3���ܽ��С��Ca3(VO4)2����Ca3(VO4)2�����м���(NH4)2CO3��Һ����ʹ���ӳ������ܳ�����ϻ�ѧ�����ƽ���ƶ�ԭ��������ԭ����______��
�� ��(NH4)3VO4��Һ�м���NH4Cl��Һ��������Һ��pH��7.5����pH��8ʱ��NH4VO3�IJ������Խ��ͣ�ԭ����______��
��4���ⶨ��Ʒ��V2O5�Ĵ��ȣ�
��ȡa g��Ʒ�����������ܽ����õ�(VO2)2SO4��Һ���ټ���b1 mL c1 mol��L1 (NH4)2Fe(SO4)2��Һ��VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O���������c2 mol��L1 KMnO4��Һ�ζ�������(NH4)2Fe(SO4)2���յ㣬����KMnO4��Һ�����Ϊb2 mL����֪ MnO4����ԭΪMn2+���������ʲ����뷴Ӧ�����Ʒ��V2O5������������______����V2O5��Ħ��������182 g��mol1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڿ����У������з�Ӧ������ ��N2 + O2 = 2NO����2NO+O2=2NO2����3NO2 + H2O = 2HNO3 + NO���� 2SO2+O2 = 2SO3���� SO3 + H2O = H2SO4�� ��SO2+H2O![]() H2SO3�� ��3O2 = 2O3����������������ԭ��Ӧ����(����)
H2SO3�� ��3O2 = 2O3����������������ԭ��Ӧ����(����)
A. �٢ڢۢ� B. �٢ڢۢܢ� C. �٢ڢܢ� D. �٢ڢۢܢݢޢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com