
【题目】在空气中,有下列反应发生: ①N2 + O2 = 2NO;②2NO+O2=2NO2;③3NO2 + H2O = 2HNO3 + NO;④ 2SO2+O2 = 2SO3;⑤ SO3 + H2O = H2SO4; ⑥SO2+H2O![]() H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
A. ①②③④ B. ①②③④⑦ C. ①②④⑦ D. ①②③④⑤⑥⑦
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】下列各离子①R-,②R+,③R2+,④R3+,⑤RH4+,⑥RH-(R表示不同的元素)都有10个电子,其中不会破坏水的电离平衡的有( )
A.仅有②③B.仅有②C.⑥D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 离子晶体中肯定不含非极性共价键
B. 原子晶体的熔点肯定高于其它晶体
C. 由分子组成的物质其熔点一定较低
D. 原子晶体中除非极性共价键外不存在其它类型的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置_______(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置_______。
(2)从碘水中分离出I2,选择装置______,该分离方法的名称为________。
(3)装置A中仪器①的名称是________,装置B在分液时为使液体顺利滴下,应进行的具体操作是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)<c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由5.6gCO、4.4gCO2及0.4gH2组成的混合气体的平均摩尔质量是____________;该混合气体相对于O2的密度为_________;该混合气体中CO的物质的量分数是__________。
(2)焦亚硫酸钠(Na2S2O5)是常用食品抗氧化剂,常用于葡萄酒、果脯等食品中。Na2S2O5中硫元素的化合价是_________,焦亚硫酸钠在空气中久置会被氧化生成连二硫酸钠(Na2S2O6),写出该反应的化学方程式__________________________________________。
(3)葡萄酒中的 Na2S2O5的使用量是以游离的 SO2 来计算的。我国规定每升葡萄酒中SO2的最高含量是 0.25g,则一瓶 800mL 的葡萄酒中 SO2的物质的量不能超过______(精确到 0.001 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定对工农业及人类生存具有重大意义。
合成氨是最重要的人工固氮:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。
2NH3(g) △H<0。
(1)下列关于该反应的说法中,正确的是___________(填正确选项字母编号)。
A.反应达到平衡状态时,N2、H2、NH3的体积比为1∶3∶2
B.加催化剂可以加快正反应速率,减慢逆反应速率
C.高温既有利于加快反应速率也有利于提高氨气的产率
D.高压既有利于加快反应速率也有利于提高氨气的产率
(2)一定温度下,在容积为1L的密闭容器中,加入lmolN2和3mol H2,反应达到平衡时H2的转化率为60%,此时反应消耗N2物质的量为___________mol;保持容器体积不变,再向容器中加入1molN2,3mol H2,反应再次达到平衡时,氢气的转化率将___________(填“增大”或“减小”或“不变”)。
(3)标准状况下,将22.4 mL的氨气通入100 mL 0.01 mol·L-1的盐酸中,充分反应后,溶液中各离子浓度由大到小的顺序是________________________。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学反应方程式为____________________。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递 H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如图所示,写出阴极的电极反应式____________________。
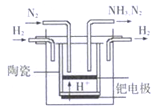
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com