
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素,Y是地壳中含量最高的元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是
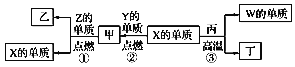
A.反应③为工业制粗硅的原理
B.Z位于元素周期表第三周期ⅡA族
C.4种元素的原子中,Y原子的半径最小
D.工业上通过电解乙来制取Z
科目:高中化学 来源: 题型:
【题目】对甲基苯胺可用对硝基甲苯作原料在一定条件制得。 主要反应及装置如下:
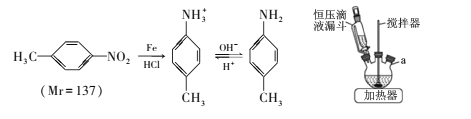
主要反应物和产物的物理性质见下表:
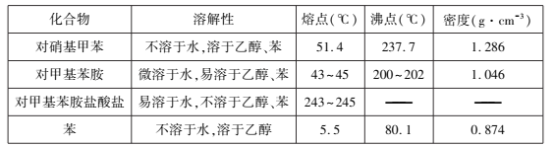
实验步骤如下:
①向三颈烧瓶中加入50mL稀盐酸、10.7mL(13.7g)对硝基甲苯和适量铁粉,维持瓶内温度在80℃左右,同时搅拌回流、使其充分反应;
②调节pH=7~8,再逐滴加入30mL苯充分混合;
③抽滤得到固体,将滤液静置、分液得液体M;
④向M中滴加盐酸,振荡、静置、分液,向下层液体中加入NaOH溶液,充分振荡、静置;
⑤抽滤得固体,将其洗涤、干燥得6.1g产品。
回答下列问题:
(1)主要反应装置如上图,a处缺少的装置是____ (填仪器名称),实验步骤③和④的分液操作中使用到下列仪器中的_____(填标号)。
a.烧杯 b.漏斗 c.玻璃棒 d.铁架台
(2)步骤②中用5%的碳酸钠溶液调pH =7~8的目的之一是使Fe3+ 转化为氢氧化铁沉淀,另一个目的是 ____。
(3)步骤③中液体M是分液时的____ 层(填“上”或“下”)液体,加入盐酸的作用是____。
(4)步骤④中加入氢氧化钠溶液后发生反应的离子方程式有____。
(5)步骤⑤中,以下洗涤剂中最合适的是____ (填标号)。
a.乙醇 b.蒸馏水 c.HCl溶液 d.NaOH溶液
(6)本实验的产率是_____%。(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下反应:Fe3++AgFe2++Ag+的平衡常数K=0.3。现将含0.010mol/LFe(NO3)2和0.10mol/L Fe(NO3)3的混合溶液倒入烧杯甲中,将含0.10mol/L的AgNO3溶液倒入烧杯乙中(如图),闭合开关 K,关于该原电池的说法正确的是
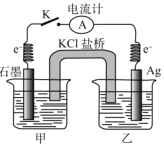
A.原电池发生的总反应中Ag+氧化Fe2+
B.盐桥中阳离子从左往右作定向移动
C.石墨为负极,电极反应为Fe2+-e-= Fe3+
D.当电流计指针归零时,总反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸(![]() )是制备感光树脂的重要原料,某肉桂酸粗产品中含有苯甲酸及聚苯乙烯,各物质性质如表:
)是制备感光树脂的重要原料,某肉桂酸粗产品中含有苯甲酸及聚苯乙烯,各物质性质如表:
名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 水中溶解度(25℃) |
苯甲醛 | 106 | -26 | 179.62 | 微溶 |
聚苯乙烯 | 104n | 83.1~105 | 240.6 | 难溶 |
肉桂酸 | 148 | 135 | 300 | 微溶(热水中易溶) |
实验室提纯肉桂酸的步骤及装置如下(部分装置未画出),试回答相关问题:
2g粗产品和30mL热水的混合物![]()
![]() 滤液
滤液![]()
![]() 称重
称重
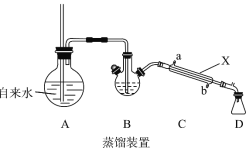
(1)装置A中长玻璃导管的作用是_________,步骤①使苯甲醛 随水蒸汽离开母液,上述装置中两处需要加热的仪器是____________(用字母 A、B、C、D回答)。
(2)仪器X的名称是_______,该装置中冷水应从___________口(填a或b)通入。
(3)步骤②中,10%NaOH溶液的作用是___________,以便过滤除去聚苯乙烯杂质。
(4)步骤④中,证明洗涤干净的最佳方法是________,若产品中还混有少量NaCl,进一步提纯获得肉桂酸晶体方法为_________________。
(5)若本实验肉桂酸粗产品中有各种杂质50%,加碱溶解时损失肉桂酸10%,结束时称重得到产品0.6g,若不计操作损失,则加盐酸反应的产率约为_____%(结果精确至0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数逐渐增大的A、B、C、D、E五种短周期主族元素的部分信息如下表:
元素代号 | 信息 |
A | 原子的最外层电子数为内层电子总数的3倍 |
B | 金属性最强的短周期元素 |
C | 原子的最外层电子数是次外层的 |
D | 原子是最外层电子数A原子的最外层电子数的一半 |
E | 最高价氧化物对应的水化物是最强的无机酸 |
请根据以上信息回答问题。
(1)C的氧化物的化学式为_______________A原子结构示意图为_______________。
(2)B、C、D形成的单质的熔点从低到高的顺序为_______________(填元素符号)。
(3)A、C所形成的化合物的晶体结构与氯化钠晶体结构相似,则晶胞中每个阳离子周围等距且紧邻的阴离子数目为_______________,晶体中阴、阳离子个数比为_______________。
(4)A、D所形成晶体的熔点比C、E所形成晶体的熔点_______________(填“高”或“低”),原因是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
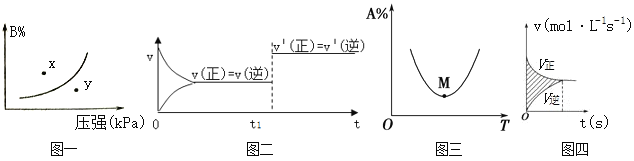
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)下列基态原子或离子的电子排布式或轨道表示式正确的是_______(填序号,下同),违反能量最低原理的是_____,违反泡利不相容原理的是_____,违反洪特规则的是_______。
①Si:![]()
②Al:![]()
③Co3+最外层:![]()
④Mg2+:1s22s22p6
⑤Sc:1s22s22p63s23p63d3
⑥Cr:1s22s22p63s23p63d54s1
(2)物质:①甲烷 ②硫化氢 ③氢氧化镁 ④氨气 ⑤乙烯
条件 | 符合条件物质的序号 |
既含极性键又含非极性键 | ______ |
含有极性键的极性分子 | ______ |
上述分子中键角由大到小的顺序 | ______ |
(3)甲图FeO晶胞中与Fe2+最近的Fe2+的个数为__________;乙图晶胞中A、B两种微粒个数比为______;丙图晶胞中A、B两种微粒个数比为_________。
甲.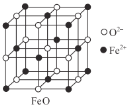 乙.
乙.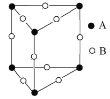 丙.
丙.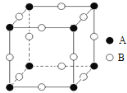
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com