
【题目】铝土矿(主要成分为Al2O3,还含有杂质SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

(1)沉淀 A、B的成分分别是____________、____________;步骤②中的试剂a是_________(以上均填化学式)。
(2)试写出步骤③中发生反应的离子方程式__________________。
(3)简述检验所得滤液甲中存在Fe3+的操作方法:__________________。
【答案】SiO2 Fe(OH)3 NaOH CO2 +OH- =HCO3- ;CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3- 取少量滤液甲于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+
【解析】
铝土矿的主要成分为Al2O3,还含有杂质SiO2、Fe2O3,加稀盐酸后Al2O3 、Fe2O3溶解变成Al3+、Fe3+,SiO2不溶,过滤后沉淀A为SiO2;滤液乙中通入过量二氧化碳 生成碳酸氢钠和氢氧化铝的沉淀, 说明滤液乙中含有偏铝酸钠,由此可知试剂试剂a为氢氧化钠溶液,沉淀B为氢氧化铁。
(1)结合上述分析可知沉淀 A、B的成分分别是SiO2 、Fe(OH)3;步骤②中的试剂a是NaOH。
(2)步骤③是向含有OH-、AlO2-的滤液中通入CO2,发生反应的离子方程式:CO2 +OH- =HCO3- ;CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3- ;答案:CO2 +OH- =HCO3- ;CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-。
(3)检验所得滤液甲中存在Fe3 +的的方法为:取少量滤液甲于试管中,滴入几滴KSCN溶液,观察溶液颜色;如果溶液颜色变为血红色,说明溶液中含有Fe3+ ,否则不含Fe3+;故答案为: 取少量滤液甲于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】某太阳能电池的工作原理如图所示。下列说法正确的是( )

A. 硅太阳能电池供电原理与该电池相同
B. 光照时, H+由a极区经质子交换膜向b极区迁移
C. 光照时,b极的电极反应式为 VO2+-e-+H2O=VO2++2H+
D. 夜间无光照时,a极的电极反应式为V3++e-=V2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的正极反应式为________________________。
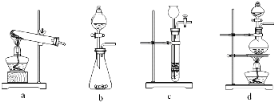
(2)已知草酸分解的化学方程式为:H2C2O4![]() CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________________。
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________________。
(3)某实验小组利用草酸分解产生的CO和铁锈反应来测定铁锈样品的组成(假定铁锈中只有Fe2O3· nH2O和Fe两种成份),实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是_______、________(填答案编号)。
a. 浓硫酸 b.澄清的石灰水 c. 氢氧化钠溶液 d. 无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)____________。
③E装置的作用是___________________________________________________________ 。
④准确称量样品10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =_____________。
⑤在本实验中,下列情况会使测定结果n偏大的是__________(填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。请用化学用语回答下列问题:
(1)F在元素周期表中的位置为_______________。
(2)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为____________________________________________。
(3)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色,H的电子式为_________________。写出在空气中长期放置生成H的化学反应方程式为:___________________________________。H的溶液与稀硫酸反应产生的现象为____________________________________。
(4)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol 熔融A4B4电离生成两种离子各1mol,则该物质熔融时的电离方程式为____________________________________。
(5)向30mL某浓度由A、B、C、D中三种元素形成的一元强碱溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。则曲线Y表明M中的溶质为_______________;原NaOH溶液的物质的量浓度为____________;由曲线X、Y可知,两次实验通入的CO2的体积比为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知NO![]() 被还原为NO),最终溶液体积为1L。下列说法正确的是( )
被还原为NO),最终溶液体积为1L。下列说法正确的是( )
A. 反应后生成NO的体积为33.6 L (标况)
B. 所得溶液中c(Fe2+)∶c(Fe3+)=1∶2
C. 所得溶液中c(NO![]() )=2.75 mol·L-1
)=2.75 mol·L-1
D. 所得溶液中的溶质只有FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是( )
CH3COOH+OH-,下列说法正确的是( )
A. 加入少量固体FeCl3, c(CH3COO-)增大
B. 加入少量NaOH固体,c(CH3COO-)增大
C. 稀释溶液,溶液的pH增大
D. 加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们发现金星大气层有一种称之为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列推测不正确的是( )
A. COS是含有极性键的共价化合物B. COS的沸点比CO2高
C. COS 电子式为![]() D. COS中所有原子满足8电子稳定结构
D. COS中所有原子满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是 ( )
A. 用醋酸除去水垢:2H++CaCO3===Ca2++CO2↑+H2O
B. 酸性氯化亚铁溶液中加入双氧水2Fe2++H2O2===2Fe3++O2↑+2H+
C. NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D. 电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com