
| 选项 | 变化过程 | 现象 |
| A | 将少量酚酞滴加到过氧化钠固体上 | 变红 |
| B | 将过量氯气通入紫色石蕊试液中 | 褪色 |
| C | 过量氨水逐滴加入氯化铝溶液中 | 先产生白色沉淀后白色沉淀消失 |
| D | 氢氧化铁胶体中加入过量稀硫酸 | 先产生红褐色沉淀后溶解,溶液变为黄色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、过氧化钠可以和水反应生成氢氧化钠和氧气,反应放热并且生成的氢氧化钠具有碱性可以使酚酞变红,而过氧化钠具有强氧化性;
B、氯气与水反应Cl2+H2O=HCl+HClO,依据盐酸与次氯酸的性质解答;
C、氢氧化铝不溶于弱碱氨水;
D、氢氧化铁胶体中加入稀硫酸胶体的聚沉产生红褐色沉淀,硫酸过量胶体溶解生成硫酸铁溶液.
解答 解:A、过氧化钠可以和水反应生成氢氧化钠和氧气,反应放热并且生成的氢氧化钠具有碱性可以使酚酞变红,而过氧化钠具有强氧化性,后褪色,故A错误;
B、氯气通入紫色石蕊试液中,氯气与水反应Cl2+H2O=HCl+HClO,盐酸具有酸性,能够使石蕊变红,次氯酸具有漂白性,能够使变红的溶液褪色,故B错误;
C、过量氨水逐滴加入氯化铝溶液中,产生白色沉淀后白色沉淀不消失,故C错误;
D、氢氧化铁胶体中加入稀硫酸胶体的聚沉产生红褐色沉淀,硫酸过量胶体溶解生成硫酸铁溶液,所以溶液呈黄色,故D正确;
故选D.
点评 本题考查了元素化合物的性质,应注意胶体具有聚沉、氢氧化铝的两性,只溶于强酸强碱,掌握基础是解题关键,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
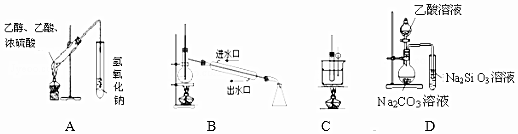
| A. | 装置用于制备乙酸乙酯 | |
| B. | 装置用于石油的分馏 | |
| C. | 装置用于实验室制硝基苯 | |
| D. | 装置可装置证明酸性:乙酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 室温下,用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH | |
| B. | 将4mL0.01mol•L-1 KSCN溶液与1mL0.01mol•L-1 FeCl3溶液充分混合,再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡::Fe3++3SCN-?Fe(SCN)3 | |
| C. | 将碱的稀溶液缓慢倒人酸的稀溶液中.所测反应后混合液温度值偏小 | |
| D. | 测定Na2SO3溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
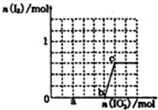 (1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
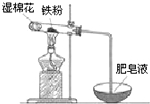 铝和铁是日常生活中用途广泛的金属.
铝和铁是日常生活中用途广泛的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 483.6 kJ•mol-1 | B. | 241.8 kJ•mol-1 | C. | 571.6 kJ•mol-1 | D. | 285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
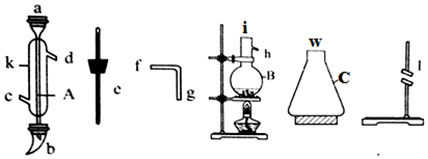
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol CO2、CO的混合气中含有的氧原子数为1.5NA | |
| B. | 标准状况下,11.2LCCl4所含的分子数为0.5 NA | |
| C. | 25℃,1.01×105Pa,66gCO2中所含原子数为4.5NA | |
| D. | 1 mol•L-1 CuCl2溶液中含有的氯离子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com