
【题目】硫、氮、氯其化合物在生产生活中应用广泛。请回答:
(1)将SO2通入品红溶液中,现象为品红溶液________,加热后溶液颜色________。
(2)已知反应:SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中的氧化产物是__________。
(3)木炭与浓硫酸共热的化学反应方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
(4)汽车尾气常含有NO、NO2、CO等,会污染空气。在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式___________。
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是___________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________
【答案】褪色 变红 H2SO4 2 2CO+2NO![]() N2+2CO2 ClO-+Cl-+2H+=Cl2↑+H2O Cl2+2NaOH=NaClO+NaCl+H2O
N2+2CO2 ClO-+Cl-+2H+=Cl2↑+H2O Cl2+2NaOH=NaClO+NaCl+H2O
【解析】
(1)二氧化硫与品红化合生成无色物质不稳定,溶液褪色,加热已褪色的溶液,溶液又恢复为红色。所以将SO2通入品红溶液中,现象为品红溶液褪色,加热后溶液颜色变红。故答案为:褪色;变红;
(2)SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中SO2中+4价的硫失去电子被氧化,得到氧化产物H2SO4。故答案为:H2SO4;
(3)C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,每生成1molCO2,转移4mol电子,若生成0.5 mol CO2,则转移电子的物质的量是2mol。故答案为:2;
CO2↑+2SO2↑+2H2O,每生成1molCO2,转移4mol电子,若生成0.5 mol CO2,则转移电子的物质的量是2mol。故答案为:2;
(4)在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体N2和CO2,反应的化学方程式2CO+2NO![]() N2+2CO2。故答案为:2CO+2NO
N2+2CO2。故答案为:2CO+2NO![]() N2+2CO2;
N2+2CO2;
(5)NaClO具有强氧化性,在酸性条件下能将Cl-氧化。“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是ClO-+Cl-+2H+=Cl2↑+H2O(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,氯气能与氢氧化钠反应生成次氯酸钠和氯化钠,反应的化学方程式:Cl2+2NaOH=NaClO+NaCl+H2O。故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;Cl2+2NaOH=NaClO+NaCl+H2O。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】氮气与氢气在催化剂表面发生合成氨反应的微粒变化历程如图所示。
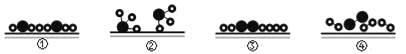
下列关于反应历程的先后顺序排列正确的是( )
A.④③①②B.③④①②C.③④②①D.④③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语回答下列问题
(1)画出钾原子的原子结构示意图:____________。
(2)写出氨分子的结构式:__________________。
(3)用电子式表示氟化钙(CaF2)的形成过程:_________________。
(4)完成下表
K层为最外层时,最多能容纳的电子数 | _________ |
除K层外,其他各层为最外层时,最多能容纳的电子数 | _________ |
次外层最多能容纳的电子数 | _________ |
倒数第3层最多能容纳的电子数 | _________ |
第n层里最多能容纳的电子数 | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为了探究铝与盐酸反应过程中的速率变化,分两组做了以下实验。
(1)甲小组同学用足量的铝与50 mL盐酸发生反应,并用排水集气法收集反应放出的氢气,实验记录如下:
时间/min | 1 | 2 | 3 | 4 | 5 | 反应结束时 |
氢气体积/mL(标准状况下) | 50 | 150 | 300 | 380 | 410 | 560 |
①哪一时间段(即0~1、1~2、2~3、3~4、4~5 min)反应速率最大__,原因是____;
②反应进行到10 min时,便不再有气泡产生,该盐酸中HCl的物质的量浓度是__,整个反应过程中HCl的反应速率为____;
(2)乙小组学生也做了同样的实验,但由于反应太快,不好测量氢气体积,他事先在盐酸中加入等体积的下列液体:A.蒸馏水、B.KCl溶液、C.KNO3溶液、D.CuSO4溶液,以减慢反应速率,你认为可行的是____,不可行的理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
(1)5min末A的物质的量浓度为________。
(2)前5min内用B表示的化学反应速率v(B)为________。
(3)化学方程式中n值为________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.2019年3月1日晚,一艘外籍冷藏运输船在山东威海荣成市荣喜港装卸过程中,货舱发生液氨泄漏事故,造成5名中国籍雇员死亡。试回答下列问题:
(1)液氨能做制冷剂的原因是_________
(2)实验室制取氨气的化学方程式为________;
Ⅱ.液氨是否泄漏可以用氯气进行检验,某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。
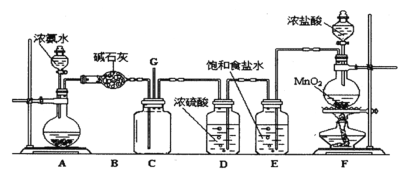
请回答下列问题:
(1)装置B中仪器的名称是_________;装置E的作用是 ____________。
(2)D中体现了浓硫酸的___________性。
(3)装置F中发生反应的化学方程式:_______,若生成标况下的氯气2.24L,则被氧化的盐酸的物质的量为__________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,试写出检验液氨泄漏的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的钠和铝的混合物与足量的水充分反应,没有金属剩余,收到2.24L气体,下列说法一定正确的是
A. 所得气体为氢气 B. 所得气体的物质的量为 0.1 mol
C. 上述过程只发生一个化学反应 D. 所得溶液中只有一种溶质
【答案】A
【解析】钠与水反应生成氢气,铝与氢氧化钠溶液反应生成氢气,所以所得气体为氢气,故A正确;非标准状况下,2.24L气体的物质的量不一定是 0.1 mol,故B错误;上述过程,发生钠与水反应生、铝与氢氧化钠溶液反应,共发生两个化学反应,故C错误;所得溶液中的溶质可能有偏铝酸钠和氢氧化钠两种溶质,故D错误。
点睛:铝能与酸反应放出氢气,铝也能与强碱溶液反应放出氢气,如![]() 。
。
【题型】单选题
【结束】
21
【题目】I.SO2是一种重要的化工原料,其合理利用以及废气处理一直是化工研究的热点。
(1)氧元素在元素周期表中位于第______周期______族,硫原子核外有_____种能量不同的电子。
(2)元素的非金属性S比O______(填“强”或“弱”),从原子结构的角度解释原因:__________。
II.工业上利用反应SO2 + MnO2 → MnSO4 可以制备高纯 MnSO4,实验装置如下图:

(3)请标出反应SO2 + MnO2 → MnSO4的电子转移方向和数目____________
(4)在通入干燥空气的条件下,一段时间后,测得反应后溶液中的 n(SO42-)明显大于 n(Mn2+),请说明原因: ___________________。用化学方程式表示石灰乳的作用: ___________________。
III.SO2可用于处理含 Cr2O72-(铬元素化合价为+6)的废水,最后转化为铬沉淀(铬元素化合价为+3)除去。一种处理流程如下:
![]()
(5)NaHSO3与 Cr2O72-反应时,物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图转化关系判断下列说法不正确的是(反应条件已略去)
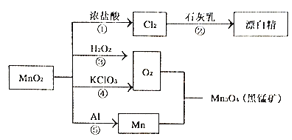
A. 反应①②③④⑤均属于氧化还原反应
B. 生成黑锰矿的反应中,3molMn参加反应转移4mol电子
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应⑤为铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是
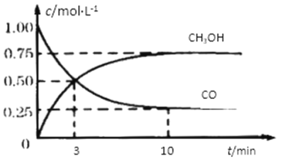
A.反应的化学方程式:CO+2H2![]() CH3OH
CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO) = 0.075 mol/L·min
D.增大压强,平衡正向移动,K不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com