
【题目】Ⅰ.2019年3月1日晚,一艘外籍冷藏运输船在山东威海荣成市荣喜港装卸过程中,货舱发生液氨泄漏事故,造成5名中国籍雇员死亡。试回答下列问题:
(1)液氨能做制冷剂的原因是_________
(2)实验室制取氨气的化学方程式为________;
Ⅱ.液氨是否泄漏可以用氯气进行检验,某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。
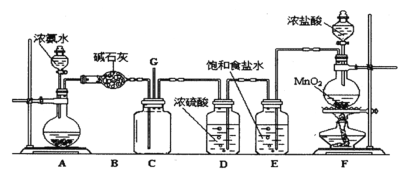
请回答下列问题:
(1)装置B中仪器的名称是_________;装置E的作用是 ____________。
(2)D中体现了浓硫酸的___________性。
(3)装置F中发生反应的化学方程式:_______,若生成标况下的氯气2.24L,则被氧化的盐酸的物质的量为__________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,试写出检验液氨泄漏的化学方程式____________。
【答案】液氨气化时要吸收大量的热使温度降低 2NH4Cl+Ca(OH)2![]() CaCl2+ 2NH3↑+2H2O 干燥管 除去氯气中的氯化氢 吸水性 MnO2+4HCl(浓)
CaCl2+ 2NH3↑+2H2O 干燥管 除去氯气中的氯化氢 吸水性 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 0.2 mol 3Cl2+8NH3 = N2+6NH4Cl
MnCl2+Cl2↑+2H2O 0.2 mol 3Cl2+8NH3 = N2+6NH4Cl
【解析】
Ⅰ.(1)液氨气化时要吸收大量的热使温度降低;
(2)实验室用NH4Cl和Ca(OH)2制取氨气;
Ⅱ.A、F分别为氨气和氯气的发生装置,装置E的作用是除去氯气中的氯化氢,D用于干燥氯气,B中碱石灰用于干燥氨气,C为纯净干燥的氯气与氨反应的装置,在C中氨气中的氮被氯气氧化生成氮气,氯气被还原成HCl,遇过量的氨气生成固体NH4Cl。
Ⅰ.(1)液氨能做制冷剂的原因是液氨气化时要吸收大量的热使温度降低,故答案为:液氨气化时要吸收大量的热使温度降低;
(2)实验室用NH4Cl和Ca(OH)2制取氨气,化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+ 2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2
CaCl2+ 2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+ 2NH3↑+2H2O;
CaCl2+ 2NH3↑+2H2O;
Ⅱ.(1)装置B中碱石灰用于干燥氨气,装置B中仪器的名称是干燥管;浓盐酸具有挥发性,装置E的作用是除去氯气中的氯化氢。故答案为:干燥管;除去氯气中的氯化氢;
(2)D用于干燥氯气,D中体现了浓硫酸的吸水性。故答案为:吸水性;
(3)装置F中发生反应是:MnO2和HCl(浓)加热后产生氯气,化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,由方程式每生成1molCl2,有2molHCl被氧化,若生成标况下的氯气2.24L,则被氧化的盐酸的物质的量为0.2mol。故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,由方程式每生成1molCl2,有2molHCl被氧化,若生成标况下的氯气2.24L,则被氧化的盐酸的物质的量为0.2mol。故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;0.2mol;
MnCl2+Cl2↑+2H2O;0.2mol;
(4)氯气和氨气的反应中,氯气被还原成HCl,遇过量的氨气生成固体NH4Cl,氨气中的氮被氯气氧化生成氮气。装置C内出现浓厚的白烟并在容器内壁凝结,说明生成物中有氯化铵固体,另一生成物是空气的主要成分之一,是氨气中的氮被氯气氧化生成的氮气,检验液氨泄漏的化学方程式3Cl2+8NH3 = N2+6NH4Cl。故答案为:3Cl2+8NH3 = N2+6NH4Cl。


科目:高中化学 来源: 题型:
【题目】SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3的反应:3SiCl4(g)+2H2(g)+Si(s)SiHCl3(g),△H=QkJmol-1,2min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1mol/L和0.2mol/L。
(1)从反应开始到平衡,v(SiCl4)=_______
(2)该反应的平衡常数表达式为K=_______,温度升高,K值增大,则Q__0(填“>”、“<”或“=”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将____(填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为_________
(5)平衡后,将容器的体积缩为10L,再次达到平衡时,H2的物质的量浓度范围为__________
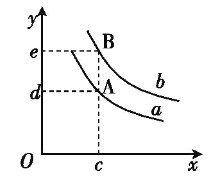
(6)图中x轴表示温度,y轴表示平衡混合气中H2的体积分数,a、b表示不同的压强,则压强a____b(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如图所示:
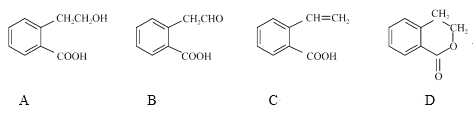
(1)A的分子式是____;B中的含氧官能团名称是____。
(2)A→B的反应类型是___;A~D中互为同分异构体的是___(填代号)。
(3)D在酸性条件下水解的化学方程式是____。
(4)B与足量新制Cu(OH)2悬浊液反应的化学方程式是___________。
(5)符合下列条件的A的同分异构体有____种。
①官能团与A完全相同且与苯环直接相连;②苯环上有三个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、氮、氯其化合物在生产生活中应用广泛。请回答:
(1)将SO2通入品红溶液中,现象为品红溶液________,加热后溶液颜色________。
(2)已知反应:SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中的氧化产物是__________。
(3)木炭与浓硫酸共热的化学反应方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
(4)汽车尾气常含有NO、NO2、CO等,会污染空气。在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式___________。
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是___________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B. c(H+)/c(OH﹣) =1×10-12的溶液中:K+、Na+、![]() 、
、![]()
C. c(Fe2+)=1 molL-1的溶液中:K+、![]() 、
、![]() 、
、![]()
D. 能使甲基橙变红的溶液中:Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,还含有少量Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按如下流程进行生产,以制备金属镁。

本流程操作条件下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 10.0 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
*Fe2+氧氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+后生成Fe(OH)3沉淀除去。 请回答以下问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施有 __________________________ (任写一条)。
(2)步骤②中NaClO的电子式为__________,加入NaClO溶液的目的是_________________________
(用离子方程式解释)。
(3)常温时,Mg(OH)2的Ksp=1.8×10-11。当溶液pH=10.0时,溶液中的c(Mg2+)=___________。
(4)若将步骤⑤中“稀盐酸”改为“加水、煮沸”的方式可以得到另一种沉淀物和一种无色无味的气体,请写出该反应的化学方程式__________________________________________。
(5)步骤⑥中涉及的操作是_____________________________,且⑥⑦操作均需在HCl气流中进行,其原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
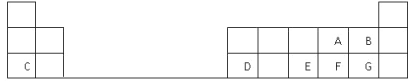
(1)画出C的原子结构示意图__________。
(2)D在元素周期表中的位置是第三周期第________族。
(3)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式______________________。
(6)A、C、D的简单离子半径大小关系是__________________ (用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com