
【题目】SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3的反应:3SiCl4(g)+2H2(g)+Si(s)SiHCl3(g),△H=QkJmol-1,2min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1mol/L和0.2mol/L。
(1)从反应开始到平衡,v(SiCl4)=_______
(2)该反应的平衡常数表达式为K=_______,温度升高,K值增大,则Q__0(填“>”、“<”或“=”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将____(填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为_________
(5)平衡后,将容器的体积缩为10L,再次达到平衡时,H2的物质的量浓度范围为__________
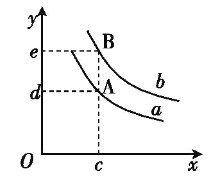
(6)图中x轴表示温度,y轴表示平衡混合气中H2的体积分数,a、b表示不同的压强,则压强a____b(填“>”、“<”或“=”)。
【答案】0.075mol/(L·min) ![]() > 减小 89.6L 0.1mol/L<c(H2)<0.2mol/L >
> 减小 89.6L 0.1mol/L<c(H2)<0.2mol/L >
【解析】
(1)利用三段分析法,根据平衡时H2与SiHCl3物质的量浓度,求出的起始H2物质的量以及2分钟时转化的物质的量,在根据v(H2)=![]() 计算出氢气的反应速率,最后根据反应速率之比等于系数之比求出v(SiCl4);
计算出氢气的反应速率,最后根据反应速率之比等于系数之比求出v(SiCl4);
(2)根据反应的平衡常数等于生成物各物质的浓度的幂次方之积比反应物各物质的浓度的幂次方之积,注意纯固体或者纯液体不列出;温度升高,K值增大,说明平衡向正反应方向移动,正反应方向即为吸热方向;
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),等效于先将容器扩大一倍,在压缩增大压强平衡向着体积减小的方向移动即正方向移动,故H2的体积分数将减小;
(4)根据(1)三段分析法进行计算;
(5)平衡后,将容器的体积缩为10L,相当于增大压强平衡要向正方向移动进行判断;
(6)由图象曲线的变化特点可知,采用“定一仪二”法讨论。
(1)由方程式可知
3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g)
4SiHCl3(g)
起始量(mol) n 0
变化量(mol) 2x 4x
平衡量(mol) n-2x 4x
4x=0.2mol/L×20L=4mol,x=1mol;n-2x=0.1mol/L×20L=2mol,n=4mol,则v(H2)=![]() =
=![]() =0.05molL-1min-1,根据反应速率之比等于系数之比可得v(SiCl4)=
=0.05molL-1min-1,根据反应速率之比等于系数之比可得v(SiCl4)=![]() v(H2)=0.075molL-1min-1;
v(H2)=0.075molL-1min-1;
(2)根据反应的平衡常数等于生成物各物质的浓度的幂次方之积比反应物各物质的浓度的幂次方之积,K=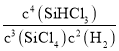 ;温度升高,K值增大,说明平衡向正反应方向移动,正反应方向即为吸热方向,所以Q>0;
;温度升高,K值增大,说明平衡向正反应方向移动,正反应方向即为吸热方向,所以Q>0;
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),等效于先将容器扩大一倍,在压缩相当于增大压强平衡向着体积减小的方向移动即正方向移动,故H2的体积分数将减小;故答案:减小;
(4)根据(1)三段分析法计算得,通入H2的体积(标准状况下)为4mol×22.4mol/L=89.6L;
(5)平衡后,将容器的体积缩为10L,如果平衡不移动H2的物质的量浓度变成原来的2倍即![]() ×2=0.2mol/L,但是体积压缩相当于增大压强平衡要向正方向移动进行,H2的物质的量浓度还要减小,但根据勒夏特列原理,再减小也会比原来的大;故答案为0.1molL-1<c(H2)<0.2molL-1;
×2=0.2mol/L,但是体积压缩相当于增大压强平衡要向正方向移动进行,H2的物质的量浓度还要减小,但根据勒夏特列原理,再减小也会比原来的大;故答案为0.1molL-1<c(H2)<0.2molL-1;
(6)由图象曲线的变化特点可知,采用“定一仪二”法讨论,定温度相同,增大压强,平衡向正反应的方向移动,H2的体积分数减小,则说明a>b。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】一氯甲烷的某些物理数据如下表:

在实验室里可用如图装置制备一氯甲烷:
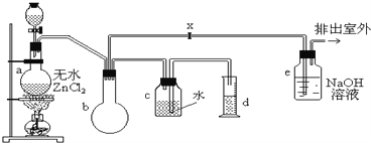
制备装置的分液漏斗中盛有甲醇,烧瓶中盛有浓盐酸。
请填写下列空白:
(1)制备一氯甲烷的化学方程式是__________;该反应属于反应__________;
(2)装置e中可能发生反应的化学方程式是__________________;
(3)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃的燃烧现象有明显区别,且生成物中有HCl),CH3Cl燃烧的化学方程式是____________;
(4)装置b的作用是________,某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇和浓盐酸的量比理论计算的量多(装置的气密性没有问题),其原因是________,实验结束后,d中收集到的液体中含有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) + Q,下列叙述正确的是
2Z(g)+W(s) + Q,下列叙述正确的是
A.加入少量W,υ(逆)增大B.压强不变时,反应达到平衡状态
C.升高温度,υ(逆)、υ(正)都增大D.平衡后加入X,方程式中的Q增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿物样品(已经剔除其它杂质)含三种氧化物:Al2O3、Fe2O3、CuO,化学兴趣小组欲将三种金属化合物加以分离,最终制得相应的纯净化合物或溶液.实验方案大致如下:
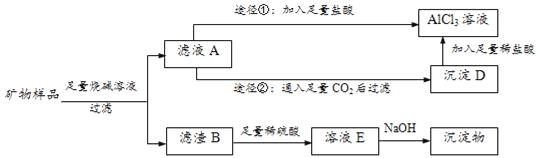
(1)纯Fe2O3、CuO的颜色依次是___色、___色。
(2)写出滤液A的主要溶质成分:___。
(3)由滤液A制AlCl3溶液有①和②两种途径,②与①相比自有其合理之处,理由是:___。
(4)溶液E中含有三种阳离子.向E中分步滴加NaOH溶液,三种阳离子先后与OH﹣结合,其中列第二位的阳离子能使某种试剂变为血红色,这种试剂是___。若矿物样品的质量为m1,所得Fe(OH)3的质量为m2,则样品中Fe2O3的质量分数为___。若使Fe3+沉淀这一步加入的NaOH过量,该测定值将___(填“偏高”、“偏低”或“不变”)。
(5)将Cu(OH)2溶于稀硫酸,然后制成胆矾晶体,必要的操作步骤依次包括蒸发浓缩、___、___、洗涤、自然干燥等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气与氢气在催化剂表面发生合成氨反应的微粒变化历程如图所示。
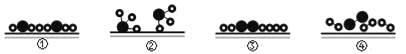
下列关于反应历程的先后顺序排列正确的是( )
A.④③①②B.③④①②C.③④②①D.④③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.224mLB.168mLC.336mLD.448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤的干馏产品之一煤焦油中可分离出蒽(![]() ),再经升华提纯得到的高纯度蒽可用作闪烁计数器的闪烁剂。下列关于蒽的说法错误的是
),再经升华提纯得到的高纯度蒽可用作闪烁计数器的闪烁剂。下列关于蒽的说法错误的是
A. 化学式为C14H10
B. 一定条件下能发生取代、加成、氧化等反应
C. 具有12种二氯代物
D. 与菲( )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
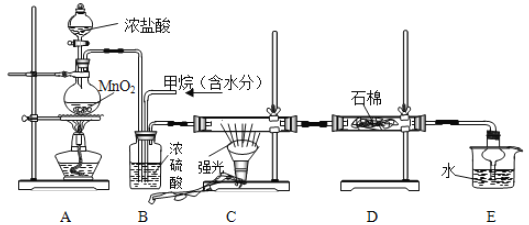
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学反应方程式:___________。
(2)B装置有三种功能;①控制气流速度;②混匀混合气体;③________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有___溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
A分液法 B蒸馏法 C结晶法
(5)将1molCH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为_____,生成HCl的物质的量共为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.2019年3月1日晚,一艘外籍冷藏运输船在山东威海荣成市荣喜港装卸过程中,货舱发生液氨泄漏事故,造成5名中国籍雇员死亡。试回答下列问题:
(1)液氨能做制冷剂的原因是_________
(2)实验室制取氨气的化学方程式为________;
Ⅱ.液氨是否泄漏可以用氯气进行检验,某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。
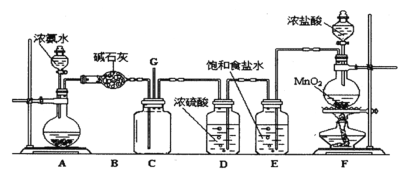
请回答下列问题:
(1)装置B中仪器的名称是_________;装置E的作用是 ____________。
(2)D中体现了浓硫酸的___________性。
(3)装置F中发生反应的化学方程式:_______,若生成标况下的氯气2.24L,则被氧化的盐酸的物质的量为__________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,试写出检验液氨泄漏的化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com