
【题目】某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) + Q,下列叙述正确的是
2Z(g)+W(s) + Q,下列叙述正确的是
A.加入少量W,υ(逆)增大B.压强不变时,反应达到平衡状态
C.升高温度,υ(逆)、υ(正)都增大D.平衡后加入X,方程式中的Q增大
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为____________。
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,则2CO2(g)+ 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的nCO2/nH2值变小
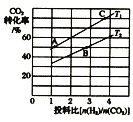
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3) =___;KA、KB、KC三者之间的大小关系为_____。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c (NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中发生反应:4A(s)+3B(g)2C(g)+D(g),2min后B减小了1.2mol.有关此反应的说法正确的是( )
A. 在 2min 内的反应速率,用 C 表示是 0.4mol/(Lmin)
B. 分别用 B、C、D 表示化学反应速率其比值是 3:2:1
C. 达到化学反应限度时,B 物质转化率为 100%
D. 向容器中增加 A 的投量,可以加快该反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系表示正确的是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系表示正确的是( )
A. 5v(NH3)/6=v(O2)B. 5v(O2)/6=v(H2O)
C. 2v(NH3)/2=v(H2O)D. 4v(O2)/5=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是
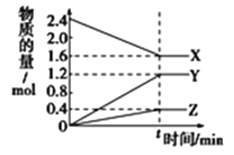
A.反应的化学方程式为![]()
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若![]() ,则
,则![]() X的化学反应速率为0.1molL-1min-1
X的化学反应速率为0.1molL-1min-1
D.温度、体积不变,t时刻充入1molHe使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
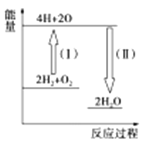
(1)氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)=2H2O(1),生成2mol液态水放出572kJ的能量,请回答下列问题:
①生成物能量总和___(填“大于”“小于”或“等于”)反应物能量总和。
②反应2H2+O2![]() 2H2O的能量变化如图所示。已知拆开1mol H2、1mol O2和1mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)____(填“吸收”或“放出”)___kJ。
2H2O的能量变化如图所示。已知拆开1mol H2、1mol O2和1mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)____(填“吸收”或“放出”)___kJ。
(2)一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
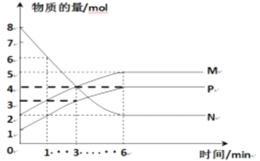
①反应化学方程式中各物质的系数比为a:b:c=____。
②1min到3min这段时刻,以M的浓度变化表示的平均反应速率为:_______。
③下列叙述中能说明上述反应达到平衡状态的是_________。
A 反应中当M与N的物质的量相等时
B P的质量不随时间变化而变化
C 混合气体的总物质的量不随时间变化而变化
D 单位时间内每消耗a mol N,同时消耗b mol M
E 混合气体的压强不随时间的变化而变化
M 的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
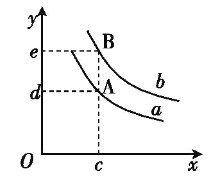
【题目】SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3的反应:3SiCl4(g)+2H2(g)+Si(s)SiHCl3(g),△H=QkJmol-1,2min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1mol/L和0.2mol/L。
(1)从反应开始到平衡,v(SiCl4)=_______
(2)该反应的平衡常数表达式为K=_______,温度升高,K值增大,则Q__0(填“>”、“<”或“=”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将____(填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为_________
(5)平衡后,将容器的体积缩为10L,再次达到平衡时,H2的物质的量浓度范围为__________
(6)图中x轴表示温度,y轴表示平衡混合气中H2的体积分数,a、b表示不同的压强,则压强a____b(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com