
甲容器中发生了某化学反应,测得反应过程中,容器中存在Na+、H2O、CN-、ClO-、HCO3-、N2、Cl-七种粒子,其中ClO-和N2的物质的量随时间变化的曲线如图所示。根据题意完成下列填空:
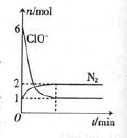
(1)CN一中氮元素的化合价是 。
(2)甲容器中发生反应的离子方程式是 。该反应的氧化产物是 (填化学式)。
(3)乙容器中用ClO2代替ClO-,溶液呈碱性,若最终两容器中N2的物质的量相同。则甲、乙两容器中参加反应的氧化剂的物质的量之比为 。
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| 11m-3b |
| 11m |
| 11m-3b |
| 11m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年海南省琼海市嘉积中学高二下教学质量监测二化学卷(带解析) 题型:单选题
在容积不变的密闭容器中发生如下反应2A(g)+B(g) 2C(g) △H<0。某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究。下列关于图像的分析正确的是( )
2C(g) △H<0。某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究。下列关于图像的分析正确的是( )
①图I研究的是t1时刻增大B的浓度对反应速率的影响
②图Ⅱ研究的是t1时刻通入氦气增大体系压强对反应速率的影响
③图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
④图Ⅲ研究的是温度对化学平衡的影响,且乙的温度高于甲的温度
| A.①② | B.②③ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:2014届海南省琼海市高二下教学质量监测二化学卷(解析版) 题型:选择题
在容积不变的密闭容器中发生如下反应2A(g)+B(g) 2C(g) △H<0。某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究。下列关于图像的分析正确的是( )
2C(g) △H<0。某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究。下列关于图像的分析正确的是( )

①图I研究的是t1时刻增大B的浓度对反应速率的影响
②图Ⅱ研究的是t1时刻通入氦气增大体系压强对反应速率的影响
③图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
④图Ⅲ研究的是温度对化学平衡的影响,且乙的温度高于甲的温度
A.①② B.②③ C.②③ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com