
[选修2——化学与技术] Ⅰ.下列有关叙述正确的是( )
A.碱性锌锰电池中,MnO2是催化剂
B.银锌纽扣电池工作时,Ag2O被还原为Ag
C.放电时,铅酸蓄电池中硫酸浓度不断增大
D.电镀时,待镀的金属制品表面发生还原反应
Ⅱ.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
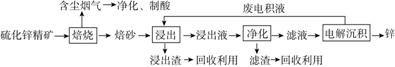
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____________________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的________操作。
(3)浸出液“净化”过程中加入的主要物质为________,其作用是________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生主要反应的离子方程式为__________________________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。” 该炼锌工艺过程主要反应的化学方程式为________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
下列反应中,既属于氧化还原反应,又是吸热反应的是
A.铝片与稀盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.酒精在空气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
2 mol A与2 mol B混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g) 
 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=v(A)=0.2 mol·L-1·s-1 B.z=3
C.B的转化率为75% D.反应前与2 s后容器的压强比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
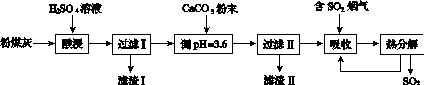
(1)酸浸时反应的化学方程式为____________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是__________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
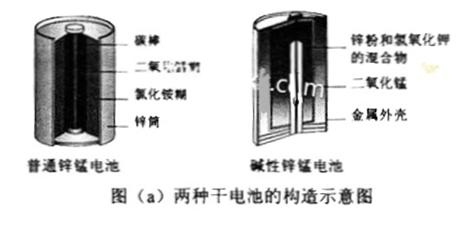
回答下列问题:
(1) 普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
① 该电池中,负极材料主要是 ________,电解质的主要成分是______,正极发生的主要反应是_______
________,电解质的主要成分是______,正极发生的主要反应是_______ 
 。
。
② 与普通锌锰电池相比,碱性锌锰电池的优点及其理由是
_______ 。
(2)
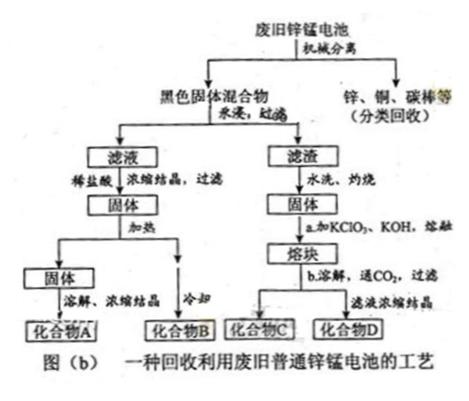 |
 废旧电池中实际存在的少量其他金属)。
废旧电池中实际存在的少量其他金属)。 (3)图(b)中产物的化学式分别为A_______,B________。
① 操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为
_______ 。
② 采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
普通纸张的成分是纤维素,在早期的纸张生产中,常采用纸表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______。为防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______。
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是______。
②喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾,钛白粉的一种工业制法是以钛铁矿主要成分(FeTiO3)为原料按下过程进行的,请完成下列化学方程式
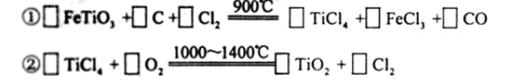
查看答案和解析>>
科目:高中化学 来源: 题型:
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是( )
A.4Fe(OH)2+2H2O+O2====4Fe(OH)3↓
B.2Fe+2H2O+O2====2Fe(OH)2↓
C.2H2O+O2+4e-====4OH-
D.Fe-3e-====Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com