

分析 (1)E为邻二甲苯;
(2)结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
(3)苯不能被酸性KMnO4溶液氧化,间二甲苯能被酸性KMnO4溶液氧化;
(4)根据结构越对称,熔沸点越低解题.
解答 解:(1)C为对二甲苯,D为间二甲苯,E为邻二甲苯,故答案为:E;
(2)A、B、C的结构简式中都含有苯环,分子式依次相差1个“CH2”,符合通式CnH2n-6(n≥6),所以它们互为同系物,故答案为:b;
(3)苯不能被酸性KMnO4溶液氧化,间二甲苯能被酸性KMnO4溶液氧化,故可用之检验,故答案为:取少量A、D分别装入两支试管中,向两支试管中滴入少量酸性KMnO4溶液,振荡,若溶液褪色,则为间二甲苯;若溶液不褪色,则为苯;
(4)对二甲苯的对称性最好,邻二甲苯的对称性最差,故熔沸点由高到低:E>D>C,故答案为:E>D>C.
点评 本题考查有机物的结构与性质,注意习题中的信息分析物质的性质,把握官能团与性质的关系为解答的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1:1:1 | B. | 2:2:1:2 | C. | 1:3:1:1 | D. | 4:3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑦ | B. | ①②③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.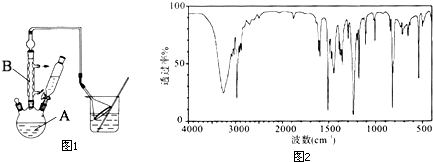
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| I1 | I2 | I3 | I4 | … |
| 496 | 4 562 | 6 912 | 9 540 | … |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:2 | D和E 1:3 | B和E 1:4 |
 .B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
.B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol O2和0.3mol H2O | |
| B. | 6.02×1023个CO2与0.1 mol KMnO4 | |
| C. | 0.1mol CuSO4•5H2O与0.1 mol C6H12O6 | |
| D. | 0.2mol SO3与0.3mol SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 加硫酸的序号 | 加硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com