
����Ŀ���������⡿����ȩ������ˮ���������л��ܼ����ܶ�Լ����ˮ���ܶȣ��ڼ��������·����绯��Ӧ�����Ʊ�����ȩ����ˮ���ܽ�Ȳ����������л��ܼ����ܶ�Լ����ˮ���ܶȣ��������ᡣ��Ӧԭ�����£�
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
������������������±���
����ȩ | ���״� | ������ | �� | |
�е�/�� | 178 | 205 | 249 | 80 |
�۵�/�� | 26 | -15 | 122 | 5.5 |
��������ˮ�е��ܽ�� | ||
17�� | 25�� | 100�� |
0.21g | 0.34g | 5.9g |
ʵ���������£�

��1���ڢ�����������1Сʱ����ͼ1�������м��Ȼ�Ϲ̶�װ��Ϊ������

����A������Ϊ_______����������B��Ϊ����C��Ч������B��˵��ԭ��_______��
��2���������йط�Һ©����ʹ�ò���ȷ����_______
A.��Һ©����ʹ��֮ǰ��������Ƿ�©ˮ
B.��Һ©���ڵ�Һ�岻�ܹ��࣬����������
C.�����Һ©����������̨�Ͼ��ã��ֲ���������������з�Һ
D.��Һʱ���²�Һ�����������ر������������ձ��ٴ�����ʹ�ϲ�Һ������
��3�����������÷�ˮԡ���������ٽ��в����ܣ���ͼ2�����ռ�______�����֡�ͼ2����һ�����Դ�����ȷ��Ӧ��Ϊ_____________��

��4������ʱ����ͼ3���ձ��б����ᾧ��ת�벼��©��ʱ�������ϻ�ճ���������壬��_____��ϴ�����ϲ����ľ��塣������ɺ���������ˮ�Ծ������ϴ�ӣ�ϴ��Ӧ____________��

��5���õ�����ƽȷ��ȡ0.2440g����������ƿ�м�100mL����ˮ�ܽ⣨��Ҫʱ���Լ��ȣ�������0.1000mol/L�ı�����������Һ�ζ��������ı�����������Һ19.20mL��������Ĵ���Ϊ_____%��
���𰸡� ������ƿ����������ƿ�� B�ĽӴ��������ȴ��������ȩ��Ч���� CD 205 �¶ȼƵ�ˮ������������ƿ��֧�ܿ� ��Һ ��Сˮ��ͷ 96.00
�����������⿼���л���ĺϳɼ������ķ��룬��ȷ��Ӧԭ�������ʵ����ʡ������ķ���ԭ�������ʼ��㷽���ǽ����Ĺؼ���
��1������װ��ͼ��֪����aΪ������ƿ������BΪ���������ܣ�����CΪֱ�������ܣ�B�ĽӴ��������ȴ��������ȩ��Ч���ã�������������B��Ϊ����C��Ч������B��
��2��A.��Һ©�����в�����������ʹ��֮ǰ��������Ƿ�©ˮ����A��ȷ��B.��Һ©���ڵ�Һ�岻�ܹ��࣬������������B��ȷ��C.����������֮ǰ��Ӧ��ʹ��Һ©�����������ϵİ��ۻ�С��©���Ͽھ�����С�ף�ʹ�������ͨ����C����D.��Һʱ���²�Һ�����������ر������������ձ����ӷ�Һ©���Ͽڽ��ϲ�Һ�嵹������D����ѡCD��
��3����������Ŀ���ǵõ����״���֣������ռ�205�����֣�����ʱ���¶ȼƲ������DZ��״��������¶ȣ������¶ȼƵ�ˮ����Ӧ����������ƿ��֧�ܿ�����
��4�����ձ��е������ᾧ��ת�벼��©��ʱ��������������ճ���������壬��ѡ��Һ�彫�����ϵľ����ϴ������ת�벼��©����Ŀ���Ǽ��پ������ʧ������ѡ���ϴ��Һ��Ӧ���Dz���ʹ�����ܽ���ʧ��Ҳ����������ʵģ�ѡ������Һ����ϴ����õġ�������ɺ���������ˮ�Ծ������ϴ�ӣ�ϴ��Ӧ��Сˮ��ͷ��
��5�����ݻ�ѧ��ӦC6H5COOH+NaOH= C6H5COONa+H2O����Ӧ����0.1000mol/LNaOH��Һ19.20mL�����ʵ���Ϊ0.1000mol/L��0.0192L=0.00192mol��������Ĵ���Ϊ��0.00192mol��122g/mol����0.2440g��100%=96.00%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����������Ҫ�ɷ�ΪAl2O3��Fe2O3��SiO2������FeS2�ͽ��������Σ�Ϊԭ�ϣ����������������Fe3O4�IJ��ֹ����������£�

��1�����չ��̾������SO2����NaOH��Һ���չ���SO2�����ӷ���ʽΪ______________________��
��2������1%CaO�Ͳ�����CaO�Ŀ�۱��գ�����ȥ�������¶ȱ仯��������16ͼ��ʾ��

��֪���������������εķֽ��¶ȶ�����600 ��
��ȥ����=��1��![]() ����100%
����100%
�ٲ�����CaO�Ŀ���ڵ���500 �決��ʱ��ȥ������Ԫ����Ҫ��Դ��__________________��
��700�決��ʱ������1%CaO�Ŀ����ȥ���ʱȲ�����CaO�Ŀ����ȥ���ʵͣ�����Ҫԭ����______________________________________________________��
��3�������������õ�����Һ��ͨ�����CO2����Ԫ�ش��ڵ���ʽ��_______________���ѧʽ��ת��Ϊ_______________���ѧʽ����
��4�����������õ��������к�������Fe2O3��Fe2O3��FeS2��Ϻ���ȱ�������±�������Fe3O4��SO2����������ȫ��Ӧ���ĵ�n��FeS2����n��Fe2O3��=__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������500��ʱ�����������������������[(NH4)2Fe(SO4)2]���ֽ���ȫ��ȷ���ֽ����ɷֵ�װ����ͼ��ʾ(��֪�ֽ�Ĺ�����������FeO��Fe2O3��Fe3O4��������������NH3��N2��H2O��SO3��SO2)������˵����ȷ����

A. ȡ���й����������ϡ���ᷴӦ���μ�KSCN����Һ��죬�������һ��ΪFe2O3
B. װ�â����ڼ���ֽ�������Ƿ���ˮ�������ɣ��Լ�X���ѡ�ü�ʯ��
C. װ�â����ڼ���ֽ�������Ƿ���SO3�������ɲ���ȥSO3��NH3
D. װ�â����ڼ���ֽ�������Ƿ���SO2�������ɣ�װ�â������ռ����ɵ�NH3��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪ���ֻ������Ԫ�����ʾ��ͼ������˵���������

A. ����Ϊij�־��д����õĻ��������ˮ�����Ϊ������
B. ����Ϊ֬�����������������Ƥ�º�����������Χ
C. ����Ϊ������Ŵ����ʣ�����͵��������Ⱦɫ��
D. ����Ϊ��ԭ��������Ҫ�ֲ����˺Ͷ���ļ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ������H2A��HA-��A2-����ˮ��Һ��ϵ�У�H2A��HA-��A2- �����и�����ռ�����ʵ�����������������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. �ں�H2A��HA-��A2- ����Һ�У���������NaOH���壬����HA-��һ������
B. �������ʵ�����NaHA��Na2A���������ˮ��������Һ������HA-��=����A2-��
C. NaHA��Һ�У�HA-��ˮ����������HA-�ĵ�������
D. �ں�H2A��HA-��A2-����Һ�У���c(H2A)+2c(A2-)+c(OH-)=c(H+)��������H2A��������HA-����һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������գ�
(1)�������������ʢ�22g������̼����5g��������1.204��1024���������ӣ���4��ʱ18gˮ������������_______������ʱ���������________(�����)��
(2)��״���£�336L��NH3����1Lˮ�У�������Һ���ܶ�Ϊag/cm3���������ʵ���Ũ��Ϊ____________��
(3)��20g�ܶ�Ϊ��g��cm-3���������Һ�ﺬ1gCa2+����NO3-�����ʵ���Ũ����_______________��
(4)�������о������ʣ���AgCl �� ͭ ��Һ̬���� ��CO2 �ݴ����� ��Ba(OH)2���� ��C2H5OH ��ϡ���� ������NaOH��
���������ڵ���ʵ���_______________________��
��������������������������֮��ɷ������ӷ�ӦH++OH-��H2O�������ӷ�Ӧ��Ӧ�Ļ�ѧ����ʽΪ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ����( )
A. 10mL0.1mol��L-1Na2CO3��Һ��εμӵ�10mL0.1mol��L-1�����У������Һ�и�����Ũ�ȵĴ�С��ϵ��c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
B. NH4HCO3��Һ�д��ڣ�C(NH4+)=C(HCO3-)+C(CO32-)+C(H2CO3)
C. �����£����ij��CaSO3��ˮ�γɵ���ҺpHΪ9����֪Ka1(H2SO3)��1.8��10-2��Ka2(H2SO3)��6.0��10-9������SO32-�ĵڶ���ˮ�⣬��Ksp(CaSO3)��3.6��10-10
D. ����������Һ��Ũ����ͬ��pH(NaX)>pH(NaY)����c(X��)��c(OH��)��c(Y��)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ������ڵ�һ���֣�Zԭ�ӵĵ��Ӳ���Ϊn������������Ϊ2n+1����������������� (����)

A. ���R��W����Ԫ���γɵ���������3������
B. RY2������ÿ��ԭ�ӵ�������Ϊ8���ӽṹ
C. R��Y��Z������������Ӧˮ���������������ǿ
D. X��Z���⻯������ȶ��Ժͻ�ԭ�ԣ������μ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25mL0.1mol/LNaOH��Һ����μ���0.2mol/L������Һ����������ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ�������У�������ǣ� ��
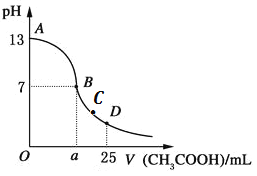
A. ��A��B����ܴ�����c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. ��B�㣺a =12.5������c(Na+)=c(CH3COO-)
C. ��C�㣺c(CH3COO-) > c(Na+) >c(H+)>c(OH-)
D. ��D�㣺c(CH3COO-) + c(CH3COOH) = 2c(Na+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com