
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力大于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
【答案】D
【解析】A. 在含H2A、HA-和A2-的溶液中,当α(HA-)较大时,加入少量NaOH固体,因HA-与OH-反应生成A2-和H2O,会使α(HA-)减小,故A错误;B. 由图可知,将等物质的量的NaHA和Na2A混合物溶于水,所得溶液的pH小于7,则HA-的电离程度大于HA-和A2-的水解程度,所以α(HA-)<α(A2-),故B错误;C. 由图可知,当HA-浓度远大于其它溶质时,溶液的pH小于7,呈酸性,说明HA-电离出的氢离子浓度远大于其水解出的氢氧根离子浓度,所以HA-的水解能力小于其电离能力,故C错误;D. 在只含H2A、HA-和A2-的溶液中,根据电荷守恒有:c(HA-)+2c(A2-)+c(OH-)=c(H+),若c(H2A)+2c(A2-)+c(OH-)=c(H+),则c(H2A)和c(HA-)相等,α(H2A)与α(HA-)也相等,但是溶液中可能还有其他阳离子,所以α(H2A)与α(HA-)不一定相等,故D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:①![]() H=180.5kJ·
H=180.5kJ·![]()
②C和CO的燃烧热(H)分别为-393.5kJ·![]() 和-283kJ·
和-283kJ·![]()
则2NO(g)+2CO(g)=N2(g)+2CO2(g) H=_________kJ·![]()
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
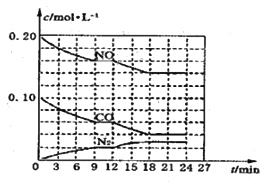
①CO在0—9min内的平均反应速率![]() =__________ mol·L-1·
=__________ mol·L-1·![]() (保留两位有效数字);第12min时改变的反应条件可能为_________。
(保留两位有效数字);第12min时改变的反应条件可能为_________。
A.升高温度 B.加入NO
C.加催化剂 D.降低温度
②该反应在第18min时又达到平衡状态,此时![]() 的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的![]() 转化为HCOOH和
转化为HCOOH和![]() 。已知常温下0.1mol·
。已知常温下0.1mol·![]() 的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH3CH=CH2)的结构或性质正确的是
A. 分子中3个碳原子在同一直线上
B. 分子中所有原子在同一平面上
C. 与氯化氢加成只生成一种产物
D. 能发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺含氮量较高,但对人体有害。一些不法乳制品企业为了提高乳制品中蛋白质含量,向乳制品中添加三聚氰胺,使儿童患肾结石。下图所示的实验装置可用来测定三聚氰胺的分子式。

已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32 g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是________________________。
(2)需要加热的装置是____________(填字母)。
(3)装置D的作用是_________________________。
(4)F处读数时应该注意:_________________、__________________。
(5)三聚氰胺的分子式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A分子的球棍模型和B分子的比例模型,回答下列问题:

(1)A和B的关系是 。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式 。
(3)写出B分子和金属钠反应的化学方程式 。
(4)B在加热条件下能够和HBr发生反应生成溴乙烷,该反应类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程下:
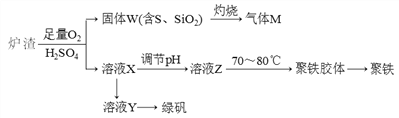
下列说法不正确的是
A. 炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+===4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示实验装置,回答下列问题:
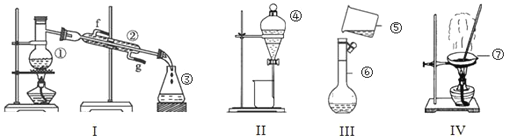
(1)写出下列仪器的名称:②_________,③_________,⑦__________。
(2)上述仪器中实验之前需检查装置是否会漏水的是______________(填仪器名称)。
(3)实验室准备用18mol/L浓硫酸配制100mL 3mol/L稀硫酸,则所需浓硫酸的体积是____mL(保留一位小数),量取浓硫酸所用量筒的规格是____(选填“10mL”、“25mL”或“50mL”)。在实验操作的摇匀过程中,不慎洒出几滴,此时应采取的措施是_______,若所配制的稀硫酸浓度偏大,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,俯视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制氯气的装置示意图,根据图示回答下列问题。
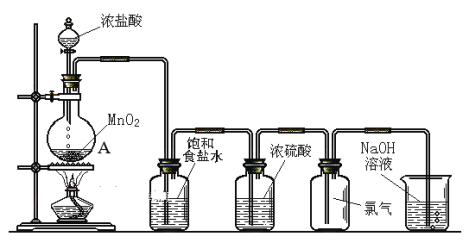
(1)写出MnO2和浓盐酸反应的化学方程式___________。
(2)A仪器的名称是___________;浓硫酸的作用___________。
(3)NaOH溶液的作用:___________;写出相关反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) ![]() CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1
(1)某研究小组,在温度和容器的容积保持不变时,研究该反应是否达到平衡状态,以下五位同学对平衡状态的描述正确的是__________。
A.甲:H2的消耗速率等于CH3OH的生成速率
B.乙:容器内的压强保持不变
C.丙:容器内气体的密度保持不变
D.丁:容器中气体的平均摩尔质量保持不变
(2)若在一定温度下、容积为2L的密闭容器中,投入2 mol CO、4 mol H2,保持恒温、恒容,测得反应达到平衡时H2转化率为75%,求平衡时CH3OH的浓度=__________mol/L
(3)已知在298K、101kPa下:甲醇的燃烧热化学方程式为:
CH3OH(l)+ 3/2 O2(g)= CO2(g)+ 2H2O(l) ΔH= -725.8 kJ·mol-1;
CO的燃烧热化学方程式为:CO(g)+ 1/2 O2(g)= CO2(g) ΔH= -283 kJ·mol-1;
H2O (g) === H2O(l) ΔH= -44 kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式__________。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)
①该电池中通入甲醇的是电源的__________(填正、负)极,若KOH溶液足量,则写出电池总反应的离子方程式__________。
②若电解质溶液中KOH的物质的量为0.5mol,当有0.5mol甲醇参与反应时,产物恰好为KHCO3时,该电池的负极反应式为__________,所得溶液中各种离子的物质的量浓度由大到小的顺序是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com