
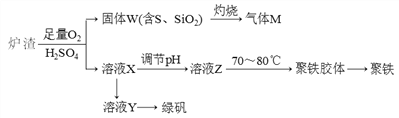
【题目】实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程下:
下列说法不正确的是
A. 炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+===4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
【答案】C
【解析】炉渣加入硫酸溶液的同时通入氧气,得到的固体W为S和SiO2,灼烧得到气体M为二氧化硫,溶液X为含有Fe3+的溶液,调节溶液pH得到溶液Z加热得到聚铁胶体,溶液X中加入铁反应生成的溶液Y为硫酸亚铁溶液,经蒸发浓缩、冷却结晶、过滤得到硫酸亚铁晶体。A. 炉渣中FeS与稀硫酸和氧气反应生成硫单质、硫酸铁和水,反应的离子方程式为4FeS+3O2+12H+=4Fe3++4S↓+6H2O,故A正确;B. 根据上述分析可知,气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用,故B正确;C. 溶液X中加入过量铁粉,铁和硫酸铁溶液反应生成硫酸亚铁,通过蒸发浓缩,冷却结晶,过滤得到绿矾,故C错误;D. 若溶液Z的pH偏小,则聚铁中生成的氢氧根离子的含量减少,硫酸根离子的含量偏大,将导致聚铁中铁的质量分数偏小,故D正确;答案选C。


科目:高中化学 来源: 题型:
【题目】Ⅰ.将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(Lmin)。
xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(Lmin)。
(1)B的反应速率v(B)=_____________,X=_____。
(2)A在5min末的浓度是________________。
(3)此时容器内的压强与开始时之比为_________。
Ⅱ.(4)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式____________;
b.指出它分子内的键型_________。
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①25 ℃时,弱电解质的电离平衡常数:K(CH3COOH)=1.8×10-5,K(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=6×10-10。②25 ℃时,2.0×10-3 mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:


请根据以上信息回答下列问题:
(1)25 ℃时,将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L HSCN溶液分别与20 mL 0.10 mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是__________,反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)。
(2)25 ℃时,HF电离平衡常数的数值Ka≈______。
(3)4.0×10-3 mol/L HF溶液与4.0×10-4mol/L CaCl2溶液等体积混合,调节混合液pH为4.0后(忽略调节时混合液体积的变化),_______沉淀产生。(填“有”或“无”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,加入0.100 molCO气体和0.080 molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=________。
(2)计算此反应在800C时的化学平衡常数k=______________。若向平衡后的体系中加入CO和CO2各0.05mol,则此时v(正)_______v (逆) 。
(3)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:C(s)+O2(g)![]() CO2(g) H =-393.5 kJ/mol,2CO(g)+ O2(g)
CO2(g) H =-393.5 kJ/mol,2CO(g)+ O2(g)![]() 2CO2(g) H=-566 kJ/mol,2H2(g)+ O2(g)
2CO2(g) H=-566 kJ/mol,2H2(g)+ O2(g)![]() 2H2O(g) H =-571.6 kJ/mol,则C(s)+H2O(g)
2H2O(g) H =-571.6 kJ/mol,则C(s)+H2O(g)![]() CO(g)+H2(g) H = __________。此反应的化学平衡表达式为:_______________________。
CO(g)+H2(g) H = __________。此反应的化学平衡表达式为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力大于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列结构的物质:①CH3(CH2)3CH3
②CH3CH2CH2CH2CH3
③CH3CH2CH2CH2CH2CH3
④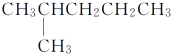
⑤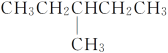
⑥
⑦
其中,属于同系物的是________;属于同分异构体的是__________;属于同种物质的是________。
A①② B②③ C③④⑤⑥⑦ D①③ E③④⑤⑦ F④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一10 L的密闭容器中充入SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。测得4 min内,O2的物质的量由开始的18 mol降到14 mol,再过t min,O2的物质的量变为10 mol。求:
2SO3(g)。测得4 min内,O2的物质的量由开始的18 mol降到14 mol,再过t min,O2的物质的量变为10 mol。求:
(1)4 min末SO3的浓度。
(2)4 min内用SO2表示的反应速率。
(3)t (填“>”“<”或“=”)4 min,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是( )。

A.正极反应式:Ca+2Cl--2e-=CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正、负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com