
【题目】已知:①25 ℃时,弱电解质的电离平衡常数:K(CH3COOH)=1.8×10-5,K(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=6×10-10。②25 ℃时,2.0×10-3 mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:


请根据以上信息回答下列问题:
(1)25 ℃时,将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L HSCN溶液分别与20 mL 0.10 mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是__________,反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)。
(2)25 ℃时,HF电离平衡常数的数值Ka≈______。
(3)4.0×10-3 mol/L HF溶液与4.0×10-4mol/L CaCl2溶液等体积混合,调节混合液pH为4.0后(忽略调节时混合液体积的变化),_______沉淀产生。(填“有”或“无”)。
【答案】 HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率较快 < 10-3.5(或3.5×10-4) 无
【解析】(1)由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)<c(SCN-),故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
(2)已知氢氟酸的电离方程式:HFH++F-,则Ka(HF)= 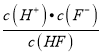 ,当c(F-)和c(HF)相等时,由Ka(HF)=
,当c(F-)和c(HF)相等时,由Ka(HF)= 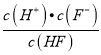 ,可知Ka(HF)=c(H+),由c(HF)、c(F-)与溶液pH的变化关系图可知,在c(F-)和c(HF)相等时图中pH=3.5左右,pH即为Ka(HF)的负对数,则Ka(HF)=10-3.5,故答案为:10-3.5;
,可知Ka(HF)=c(H+),由c(HF)、c(F-)与溶液pH的变化关系图可知,在c(F-)和c(HF)相等时图中pH=3.5左右,pH即为Ka(HF)的负对数,则Ka(HF)=10-3.5,故答案为:10-3.5;
(3)25℃时,4.0×10-3 molL-1HF溶液与4.0×10-4 molL-1 CaCl2溶液等体积混合,则HF溶液浓度为2.0×10-3molL-1,CaCl2溶液浓度为2.0×10-4molL-1;由图像知pH=4时,溶液中c(F-)浓度为1.6×10-3molL-1,所以c(Ca2+)×c2(F-)=2.0×10-4×(1.6×10-3)2=5.12×10-10<Ksp(CaF2),无沉淀产生;故答案为:无。


科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】你认为减少酸雨产生可采用的措施是( )
①少用煤作燃料 ②把工厂烟囱加高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③B.②③④⑤
C.①③⑤D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH3CH=CH2)的结构或性质正确的是
A. 分子中3个碳原子在同一直线上
B. 分子中所有原子在同一平面上
C. 与氯化氢加成只生成一种产物
D. 能发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硬脂酸甘油酯在碱性条件下水解的装置如图所示。进行皂化反应时的步骤如下:
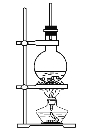
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水、10 mL酒精。加入酒精的作用为______________________;
加入NaOH溶液的作用是___________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成。证明皂化反应进行完全的方法是_______________________。
(3)皂化反应完成后,加入饱和NaCl溶液的作用是____________________。
(4)图中长玻璃导管的作用为________________________。
(5)写出该反应的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺含氮量较高,但对人体有害。一些不法乳制品企业为了提高乳制品中蛋白质含量,向乳制品中添加三聚氰胺,使儿童患肾结石。下图所示的实验装置可用来测定三聚氰胺的分子式。

已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32 g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是________________________。
(2)需要加热的装置是____________(填字母)。
(3)装置D的作用是_________________________。
(4)F处读数时应该注意:_________________、__________________。
(5)三聚氰胺的分子式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程下:
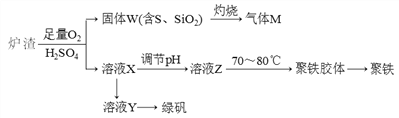
下列说法不正确的是
A. 炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+===4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2R为二元弱酸,25℃用Na2R溶液吸收H2R,吸收液的pH与![]() 的关系如下图所示:
的关系如下图所示:

下列说法中正确的是
A. NaHR溶液中:c(Na+)<c(HR-)+2c(R2-)
B. 25℃Ka1(H2R)的值为10-7.2
C. Na2R溶液中:c(Na+>c(R2-)>c(HR-)>c(OH-)
D. 当吸收液呈中性时:c(R2-)>c(HR-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com