
【题目】已知H2R为二元弱酸,25℃用Na2R溶液吸收H2R,吸收液的pH与![]() 的关系如下图所示:
的关系如下图所示:

下列说法中正确的是
A. NaHR溶液中:c(Na+)<c(HR-)+2c(R2-)
B. 25℃Ka1(H2R)的值为10-7.2
C. Na2R溶液中:c(Na+>c(R2-)>c(HR-)>c(OH-)
D. 当吸收液呈中性时:c(R2-)>c(HR-)
【答案】A
【解析】A.根据图像中吸收液的pH随![]() 变化的关系可知,随着HR-的浓度的增大,溶液酸性增强,说明NaHR溶液显示酸性,即:c(H+)>c(OH-),根据电荷守恒,c(Na+)+ c(H+)=c(HR-)+2c(R2-)+ c(OH-),因此c(Na+)<c(HR-)+2c(R2-),故A正确;B.根据图像,当
变化的关系可知,随着HR-的浓度的增大,溶液酸性增强,说明NaHR溶液显示酸性,即:c(H+)>c(OH-),根据电荷守恒,c(Na+)+ c(H+)=c(HR-)+2c(R2-)+ c(OH-),因此c(Na+)<c(HR-)+2c(R2-),故A正确;B.根据图像,当![]() =1时,pH=7.2,则25℃,Ka2(H2R)=
=1时,pH=7.2,则25℃,Ka2(H2R)=  = 10-7.2,则Ka1(H2R)>10-7.2,故B错误;C.Na2R溶液中,R2-在溶液中水解程度较小,则c(R2-)>c(HR-),由于氢氧根离子来自R2-的水解和水的电离,则c(OH-)>c(HR-),溶液中离子浓度大小为:c(Na+)>c(R2-)>c(OH-)>c(HR-)>c(H+),故C错误;D.根据图像,吸收液呈中性时,
= 10-7.2,则Ka1(H2R)>10-7.2,故B错误;C.Na2R溶液中,R2-在溶液中水解程度较小,则c(R2-)>c(HR-),由于氢氧根离子来自R2-的水解和水的电离,则c(OH-)>c(HR-),溶液中离子浓度大小为:c(Na+)>c(R2-)>c(OH-)>c(HR-)>c(H+),故C错误;D.根据图像,吸收液呈中性时,![]() >1,即c(R2-)<c(HR-),故D错误;故选A。
>1,即c(R2-)<c(HR-),故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】已知:①25 ℃时,弱电解质的电离平衡常数:K(CH3COOH)=1.8×10-5,K(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=6×10-10。②25 ℃时,2.0×10-3 mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:


请根据以上信息回答下列问题:
(1)25 ℃时,将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L HSCN溶液分别与20 mL 0.10 mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是__________,反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)。
(2)25 ℃时,HF电离平衡常数的数值Ka≈______。
(3)4.0×10-3 mol/L HF溶液与4.0×10-4mol/L CaCl2溶液等体积混合,调节混合液pH为4.0后(忽略调节时混合液体积的变化),_______沉淀产生。(填“有”或“无”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列结构的物质:①CH3(CH2)3CH3
②CH3CH2CH2CH2CH3
③CH3CH2CH2CH2CH2CH3
④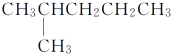
⑤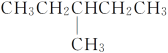
⑥
⑦
其中,属于同系物的是________;属于同分异构体的是__________;属于同种物质的是________。
A①② B②③ C③④⑤⑥⑦ D①③ E③④⑤⑦ F④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一10 L的密闭容器中充入SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。测得4 min内,O2的物质的量由开始的18 mol降到14 mol,再过t min,O2的物质的量变为10 mol。求:
2SO3(g)。测得4 min内,O2的物质的量由开始的18 mol降到14 mol,再过t min,O2的物质的量变为10 mol。求:
(1)4 min末SO3的浓度。
(2)4 min内用SO2表示的反应速率。
(3)t (填“>”“<”或“=”)4 min,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
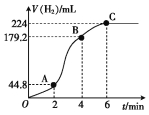
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯(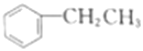 )是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
)是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
乙苯脱氢制苯乙烯:
![]() △H1=akJ/mol
△H1=akJ/mol
乙苯氯化制β-氯苯乙烷:
![]() △H2=bkJ/mol
△H2=bkJ/mol
回答下列问题:
(1)利用下表提供的数据计算a=_____。乙苯脱氢制苯乙烯的反应在_____(填“高温”或“低温”)有利于其自发进行。
化学键 | C-H | C-C | H-H | C=C |
键能/kJ/mol | 412 | 348 | 436 | 612 |
(2)已知
![]() +HCl(g)
+HCl(g)![]()
![]() △H=-54kJ/mol
△H=-54kJ/mol
H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol 则b=______________。
(3)T℃,将nmol乙苯加入到体积为V L的恒容容器中,发生脱氢反应,容器内压强随时间变化如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
压强/×100 kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
平衡时容器内气体的总物质的量为______,乙苯的转化率为______%。
(4)工业由乙苯脱氢制苯乙烯实际上是在恒压密闭容器中进行的。将m mol乙苯通入某恒压密闭容器中(反应过程中维持压强为p),乙苯的平衡转化率随温度变化如右图所示:
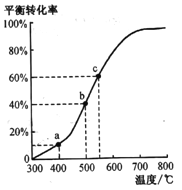
①在a点所示的条件下,向该容器中通入25L水蒸气,则乙苯的转化率______(填“变大”“变小”或不变),生成苯乙烯的速率________(填“变大”“变小”或不变)。
②b点气体总体积______(填“<”“>”或“=”)c 点气体总体积。
③c点平衡常数Kp=_______(用平衡分压代替平衡浓度,平衡分压=物质的量分数×总压)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应:2SO2+O2![]() 2SO3在不同条件下达到平衡状态时SO2的转化率。
2SO3在不同条件下达到平衡状态时SO2的转化率。
压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
试回答下列问题。
(1)关于可逆反应的限度,你能得出什么启示?
________________________________________。
(2)提高该化学反应限度的途径有:_____________________。
(3)要实现SO2的转化率为93.5%,需控制的反应条件是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是( )。

A.正极反应式:Ca+2Cl--2e-=CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正、负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如右图所示。据图判断正确的是
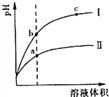
A. Ⅱ为盐酸稀释时的pH值变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com