
【题目】乙苯( )是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
)是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
乙苯脱氢制苯乙烯:
![]() △H1=akJ/mol
△H1=akJ/mol
乙苯氯化制β-氯苯乙烷:
![]() △H2=bkJ/mol
△H2=bkJ/mol
回答下列问题:
(1)利用下表提供的数据计算a=_____。乙苯脱氢制苯乙烯的反应在_____(填“高温”或“低温”)有利于其自发进行。
化学键 | C-H | C-C | H-H | C=C |
键能/kJ/mol | 412 | 348 | 436 | 612 |
(2)已知
![]() +HCl(g)
+HCl(g)![]()
![]() △H=-54kJ/mol
△H=-54kJ/mol
H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol 则b=______________。
(3)T℃,将nmol乙苯加入到体积为V L的恒容容器中,发生脱氢反应,容器内压强随时间变化如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
压强/×100 kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
平衡时容器内气体的总物质的量为______,乙苯的转化率为______%。
(4)工业由乙苯脱氢制苯乙烯实际上是在恒压密闭容器中进行的。将m mol乙苯通入某恒压密闭容器中(反应过程中维持压强为p),乙苯的平衡转化率随温度变化如右图所示:
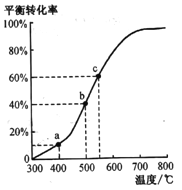
①在a点所示的条件下,向该容器中通入25L水蒸气,则乙苯的转化率______(填“变大”“变小”或不变),生成苯乙烯的速率________(填“变大”“变小”或不变)。
②b点气体总体积______(填“<”“>”或“=”)c 点气体总体积。
③c点平衡常数Kp=_______(用平衡分压代替平衡浓度,平衡分压=物质的量分数×总压)。
【答案】 +124 高温 -115 1.4nmol 40 变大 变小 < ![]()
【解析】(1)根据方程式,变化的化学键有断开了2个C-H键,C-C变成了C=C,形成了1个H-H,根据下表数据,△H=反应物总键能-生成物总键能=2×412+348-436-612=+124 kJ/mol;乙苯脱氢制苯乙烯的反应中△H>0,△S>0,根据△G=△H-T△S<0反应自发进行,因此该反应在高温下才能自发进行,故答案为:+124;高温;
(2)已知①![]() +HCl(g)
+HCl(g)![]()
![]() △H=-54kJ/mol,②H2(g)+Cl2(g)=2HCl(g)△H=-185kJ/mol,③
△H=-54kJ/mol,②H2(g)+Cl2(g)=2HCl(g)△H=-185kJ/mol,③![]() △H1=+124kJ/mol,根据盖斯定律,将①+②+③得
△H1=+124kJ/mol,根据盖斯定律,将①+②+③得![]() △H2=(-54kJ/mol)+(-185kJ/mol)+(+124kJ/mol)=-115kJ/mol,故答案为:-115;
△H2=(-54kJ/mol)+(-185kJ/mol)+(+124kJ/mol)=-115kJ/mol,故答案为:-115;
(3)设反应的乙苯的物质的量为x,
![]()
起始(mol) n 0 0
反应(mol) x x x
平衡(mol) n-x x x
根据压强之比=物质的量之比, ![]() =1.4,解得x=0.4n,平衡时容器内气体的总物质的量为1.4nmol,乙苯的转化率为
=1.4,解得x=0.4n,平衡时容器内气体的总物质的量为1.4nmol,乙苯的转化率为![]() ×100%=40%,故答案为:1.4nmol;40;
×100%=40%,故答案为:1.4nmol;40;
(4)①在a点所示的条件下,向该容器中通入25L水蒸气,容器的体积增大,相当于减小压强,![]() ,平衡正向移动,乙苯的转化率变大;减小压强,生成苯乙烯的速率变小,故答案为:变大; 变小;
,平衡正向移动,乙苯的转化率变大;减小压强,生成苯乙烯的速率变小,故答案为:变大; 变小;
②根据![]() ,乙苯的平衡转化率越大,反应后气体的总体积越大,b点气体总体积<c点气体总体积,故答案为:<;
,乙苯的平衡转化率越大,反应后气体的总体积越大,b点气体总体积<c点气体总体积,故答案为:<;
③ ![]()
起始(mol) m 0 0
反应(mol) 0.6m 0.6m 0.6m
平衡(mol) 0.4m 0.6m 0.6m
平衡分压 ![]() p
p ![]() p
p ![]() p
p
c点平衡常数Kp=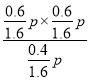 =
=![]() p,故答案为:
p,故答案为: ![]() p。
p。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】硬脂酸甘油酯在碱性条件下水解的装置如图所示。进行皂化反应时的步骤如下:
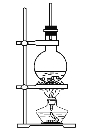
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水、10 mL酒精。加入酒精的作用为______________________;
加入NaOH溶液的作用是___________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成。证明皂化反应进行完全的方法是_______________________。
(3)皂化反应完成后,加入饱和NaCl溶液的作用是____________________。
(4)图中长玻璃导管的作用为________________________。
(5)写出该反应的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
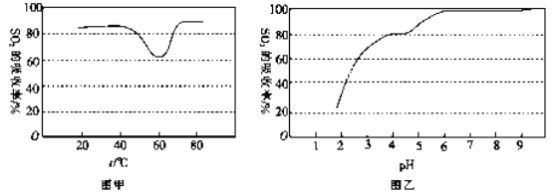
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
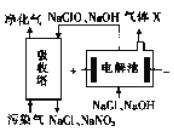
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态烃的球棍模型为: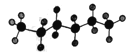 ,有机物R与该烃分子式相同,且结构中有四个甲基。下列有关R的说法中正确的是
,有机物R与该烃分子式相同,且结构中有四个甲基。下列有关R的说法中正确的是
A. R能使溴的四氯化碳溶液褪色 B. R一定是2,2-二甲基丁烷
C. R不溶于水且密度比水大 D. R的一氯代物可能有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2R为二元弱酸,25℃用Na2R溶液吸收H2R,吸收液的pH与![]() 的关系如下图所示:
的关系如下图所示:

下列说法中正确的是
A. NaHR溶液中:c(Na+)<c(HR-)+2c(R2-)
B. 25℃Ka1(H2R)的值为10-7.2
C. Na2R溶液中:c(Na+>c(R2-)>c(HR-)>c(OH-)
D. 当吸收液呈中性时:c(R2-)>c(HR-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的化学式为(NH4)2Fe(SO4)2 ,它在水溶液里电离时生成两种阳离子和一种酸根离子
(1)写出硫离子的结构示意图________________;
(2)若向该化合物的水溶液中通入氯气,一种离子很容易被氧化,该离子将变成______;(用离子符号表示)
(3)若向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则该反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如下图所示:

(1)此反应的化学方程式中=___________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________________________。
(3)下列叙述能说明上述反应达到平衡状态的是_________(填字母序号)。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:

(1)酸式电池的电极反应:负极______________,正极________________;电池总反应:___________________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:负极______________,正极_____________;电池总反应:________________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用毛笔书写后的纸张作为空气电极,设计并组装了轻型、柔性且可折叠的可充电锂空气电池(图1),电池的工作原理如图2。下列有关说法正确的是
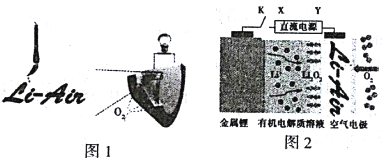
A. 放电时,纸张中的纤维素作锂电池的正极
B. 放电时,Li+由正极经过有机电解质溶液移向负极
C. 开关K闭合给锂电池充电,金属锂电极增重14g,空气电极放出22.4L的O2
D. 充电时,阳极的电极反应式为Li2O2-2e-=O2↑+2Li+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com