
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖV LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£ŗaN(g)bM(g)£¬M”¢NµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĻĀĶ¼ĖłŹ¾£ŗ

(1)“Ė·“Ó¦µÄ»Æѧ·½³ĢŹ½ÖŠ£½___________”£
(2)t1µ½t2Ź±æĢ£¬ŅŌMµÄÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ________________________”£
(3)ĻĀĮŠŠšŹöÄÜĖµĆ÷ÉĻŹö·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ_________(Ģī×ÖÄøŠņŗÅ)”£
A.·“Ó¦ÖŠMÓėNµÄĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć1
B.»ģŗĻĘųĢåµÄ×ÜÖŹĮæ²»Ėꏱ¼äµÄ±ä»Æ¶ų±ä»Æ
C.»ģŗĻĘųĢåµÄ×ÜĪļÖŹµÄĮæ²»Ėꏱ¼äµÄ±ä»Æ¶ų±ä»Æ
D.µ„Ī»Ź±¼äÄŚĆæĻūŗÄa mol N£¬Ķ¬Ź±Éś³Éb mol M
E.»ģŗĻĘųĢåµÄŃ¹Ēæ²»Ėꏱ¼äµÄ±ä»Æ¶ų±ä»Æ
”¾“š°ø”æ(1)2 (2) ![]() mol”¤L£1”¤min£1 (3)CE
mol”¤L£1”¤min£1 (3)CE
”¾½āĪö”æ
(1)»Æѧ¼ĘĮæŹżÖ®±ČµČÓŚĪļÖŹµÄĮæµÄ±ä»ÆĮæÖ®±Č£¬ĖłŅŌa”Ćb£½(8 mol£2 mol)”Ć(5 mol£2 mol)£½2”Ć1£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2N(g)![]() M(g)”£
M(g)ӣ
(2)v(M)£½![]() £½
£½![]() mol”¤L£1”¤min£1”£
mol”¤L£1”¤min£1”£
(3)“ļµ½Ę½ŗāדĢ¬Ź±£¬ø÷×é·ÖµÄÅØ¶Č²»ŌŁ·¢Éś±ä»Æ£¬ĪļÖŹµÄĮæÖ®±Č²»±ä£¬²»ÄÜĖµĆ÷ĪļÖŹµÄĮæĻąµČ£¬AŃ”Ļī“ķĪó£»øĆ·“Ó¦µÄ·“Ó¦ĪļŗĶÉś³ÉĪļ¶¼ŹĒĘųĢ壬øł¾ŻÖŹĮæŹŲŗć¶ØĀÉ£¬·“Ó¦Ē°ŗ󣬻ģŗĻĘųĢåµÄÖŹĮæŹ¼ÖÕ²»±ä£¬BŃ”Ļī“ķĪó£»øĆ·“Ó¦ĪŖĘųĢåĢå»ż¼õŠ”µÄ·“Ó¦£¬Čō·“Ӧƻӊ“ļµ½Ę½ŗāדĢ¬£¬·“Ó¦¹ż³ĢÖŠĘųĢåµÄ×ÜĪļÖŹµÄĮæŗĶŃ¹ĒæŹ¼ÖÕŌŚ¼õŠ”£¬µ±øĆĮæ²»ŌŁ·¢Éś±ä»ÆŹ±£¬ŌņĖµĆ÷·“Ó¦“ļµ½ĮĖĘ½ŗāדĢ¬£¬CŗĶEŃ”ĻīÕżČ·£»ĻūŗÄa mol NŗĶÉś³Éb mol M¶¼±ķŹ¾µÄŹĒÕż·“Ó¦ĖŁĀŹ£¬Ć»ÓŠĢåĻÖÄę·“Ó¦ĖŁĀŹµÄ“󊔣¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½ĮĖĘ½ŗāדĢ¬£¬DŃ”Ļī“ķĪó”£


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃõ»Æ»¹Ō·“Ó¦·¢ÉśŌŚĶ¬ÖÖŌŖĖŲÖ®¼äµÄŹĒ(””””)
A. Zn+2HCl![]() ZnCl2+H2ӟ
ZnCl2+H2ӟ
B. 2H2S+SO2![]() 3S”ż+2H2O
3S”ż+2H2O
C. H2+CuO![]() Cu+H2O
Cu+H2O
D. 2H2O![]() 2H2ӟ+O2ӟ
2H2ӟ+O2ӟ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹŅĪĀĻĀ£¬ĻĀĮŠČÜŅŗµČĢå»ż»ģŗĻŗó£¬ĖłµĆČÜŅŗµÄpHŅ»¶ØŠ”ÓŚ7µÄŹĒ £Ø £©
A. 0.1 mol”¤L£1 µÄĮņĖįŗĶ0.1 mol”¤L£1 µÄĒāŃõ»ÆÄĘČÜŅŗ
B. 0.1 mol”¤L£1 µÄŃĪĖįŗĶ0.1 mol”¤L£1 µÄĒāŃõ»Æ±µČÜŅŗ
C. pH=3µÄ“×ĖįŗĶpH=11µÄĒāŃõ»Æ±µČÜŅŗ
D. pH=3µÄŃĪĖįŗĶpH=11µÄĒāŃõ»Æ±µČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ²Ł×÷ÖŠ£¬ĶźČ«ÕżČ·µÄŅ»×éŹĒ( )
¢ŁÓĆŹŌ¹Ü¼Š¼Š³ÖŹŌ¹ÜŹ±£¬ŹŌ¹Ü¼Š“ÓŹŌ¹Üµ×²æĶłÉĻĢ×£¬¼ŠŌŚŹŌ¹ÜµÄÖŠÉĻ²æ
¢ŚøųŹ¢ÓŠŅŗĢåµÄĢå»ż³¬¹ż1/3ČŻ»żµÄŹŌ¹Ü¼ÓČČ
¢Ū°Ń±Ēæ×ææ½üČŻĘ÷æŚČ„ĪÅĘųĢåµÄĘųĪ¶
¢Ü½«ŹŌ¹ÜĘ½·Å£¬ÓĆÖ½²ŪĶłŹŌ¹ÜĄļĖĶČė¹ĢĢå·ŪÄ©ŗó£¬Č»ŗóŹśĮ¢ŹŌ¹Ü
¢ŻČ”ÓĆ·ÅŌŚĻøæŚĘæÖŠµÄŅŗĢåŹ±£¬Č”ĻĀĘæČūµ¹·ÅŌŚ×ĄĆęÉĻ£¬Ēćµ¹ŅŗĢåŹ±£¬ĘæÉĻµÄ±źĒ©¶Ō×ŵŲĆę
¢Ž½«ÉÕĘæ·ÅŌŚ×ĄÉĻ£¬ÓĆĮ¦Čū½ōČū×Ó
¢ßÓĆŪįŪöĒƼŠČ”¼ÓČČŗóµÄÕō·¢Ćó
¢ą½«µĪ¹Ü“¹Ö±Éģ½ųŹŌ¹ÜÄŚµĪ¼ÓŅŗĢå
¢įĻ”ŹĶÅØĮņĖįŹ±£¬°ŃĖ®ŃøĖŁµ¹ČėŹ¢ÓŠÅØĮņĖįµÄĮæĶ²ÖŠ
¢ā¼ģŃé×°ÖƵÄĘųĆÜŠŌŹ±£¬°Ńµ¼¹ÜµÄŅ»¶Ė½žČėĖ®ÖŠ£¬ÓĆŹÖĪęהȯĘ÷µÄĶā±Ś»ņÓĆ¾Ę¾«µĘĪ¢ČČ
A. ¢Ł¢Ü¢ß¢ā B. ¢Ł¢Ü¢Ż¢ß¢ā C. ¢Ł¢Ü¢Ż¢ß¢ą¢ā D. ¢Ü¢Ż¢ß¢ā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄܹ»ÓĆĄ“¼ų±šBaCl2”¢NaCl”¢Na2CO3ČżÖÖĪļÖŹµÄŹŌ¼ĮŹĒ£Ø £©
A£®AgNO3ČÜŅŗ B£®Ļ”ĮņĖį C£®Ļ”ŃĪĖį D£®Ļ”ĻõĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©ŅŃÖŖ2 molĒāĘųČ¼ÉÕÉś³ÉŅŗĢ¬Ė®Ź±·Å³ö572 kJČČĮ棬·“Ó¦·½³ĢŹ½ŹĒ2H2(g)+O2(g)==2H2O(l) Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁøĆ·“Ó¦µÄÉś³ÉĪļÄÜĮæ×ÜŗĶ___________(Ģī”°“óÓŚ”±”¢ ”°Š”ÓŚ”±»ņ”°µČÓŚ”±)·“Ó¦ĪļÄÜĮæ×ÜŗĶ”£
¢ŚČō2 molĒāĘųĶźČ«Č¼ÉÕÉś³ÉĖ®ÕōĘų£¬Ōņ·Å³öµÄČČĮæ____________(Ģī”°£¾”±”¢”°£¼”±»ņ”°£½”±)572 kJ”£
¢ŪÓė»ÆŹÆČ¼ĮĻĻą±Č£¬ĄūÓĆĒāÄÜŌ“ÓŠŗܶąÓÅµć£¬ĒėĖµ³öĘäÖŠŅ»µć______________________”£
£Ø2£©FeS2±ŗÉÕ²śÉśµÄSO2æÉÓĆÓŚÖĘĮņĖį”£ŅŃÖŖ25 ”ę”¢101 kPaŹ±£ŗ
2SO2(g)£«O2(g)![]() 2SO3(g) ¦¤H1£½£197 kJ”¤mol£1£»
2SO3(g) ¦¤H1£½£197 kJ”¤mol£1£»
H2O(g)===H2O(l) ¦¤H2£½£44 kJ”¤mol£1£»
2SO2(g)£«O2(g)£«2H2O(g)===2H2SO4(l) ¦¤H3£½£545 kJ”¤mol£1
ŌņSO3(g)ÓėH2O(l)·“Ӧɜ³ÉH2SO4(l)µÄČČ»Æѧ·½³ĢŹ½ŹĒ_________________”£
£Ø3£©ėĀ£ØN2H4£©ÓÖ³ĘĮŖ°±£¬ŹĒŅ»ÖÖæÉČ¼ŠŌµÄŅŗĢ壬æÉÓĆ×÷»š¼żČ¼ĮĻ”£·“Ó¦Ź±ŹĶ·Å“óĮæČČ²¢æģĖŁ²śÉś“óĮæĘųĢ唣ŅŃÖŖŌŚ101kPa£¬298KŹ±£¬1molŅŗĢ¬N2H4ŌŚŃõĘųÖŠĶźČ«Č¼ÉÕÉś³ÉN2ŗĶĖ®ÕōĘų£¬·Å³öČČĮæ624kJ£¬øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ__________ ”£ÓÖÖŖ£ŗH2O£Øg £©£½H2O £Øl£©”÷H£½£44 kJ”¤mol£1£¬Čō1molŅŗĢ¬N2H4ŌŚŃõĘųÖŠĶźČ«Č¼ÉÕÉś³ÉN2ŗĶŅŗĢ¬Ė®£¬Ōņ·Å³öČČĮæĪŖ______________kJ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø±¾ĢāĀś·Ö18·Ö£©¶ž¼×ĆŃ£ØCH3OCH3£©ŹĒŅ»ÖÖÓ¦ÓĆĒ°¾°¹ćĄ«µÄĒå½ąČ¼ĮĻ£¬ŅŌCOŗĶH2ĪŖŌĮĻÉś²ś¶ž¼×ĆŃÖ÷ŅŖ·¢ÉśŅŌĻĀČżøö·“Ó¦£ŗ
±ąŗÅ | ČČ»Æѧ·½³ĢŹ½ | »ÆŃ§Ę½ŗā³£Źż |
¢Ł | CO£Øg£©+2H2£Øg£© | K1 |
¢Ś | 2CH3OH£Øg£© | K2 |
¢Ū | CO£Øg£©+H2O£Øg£© | K3 |
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŅŃÖŖ·“Ó¦¢ŁÖŠµÄĻą¹ŲµÄ»Æѧ¼ü¼üÄÜŹż¾ŻČēĻĀ£ŗ
»Æѧ¼ü | H©H | C©O | C=O | H©O | C©H |
E/£ØkJ£®mol©1£© | 436 | 343 | 1076 | 45 | 413 |
ÓÉÉĻŹöŹż¾Ż¼ĘĖć”÷H1= £»
£Ø2£©øĆ¹¤ŅÕµÄ×Ü·“Ó¦ĪŖ3CO£Øg£©+3H2£Øg£©![]() CH3OCH3£Øg£©+CO2£Øg£©”÷H£¬øĆ·“Ó¦”÷H= £¬»ÆŃ§Ę½ŗā³£ŹżK= £ØÓĆŗ¬K1”¢K2”¢K3µÄ“śŹżŹ½±ķŹ¾£©£»
CH3OCH3£Øg£©+CO2£Øg£©”÷H£¬øĆ·“Ó¦”÷H= £¬»ÆŃ§Ę½ŗā³£ŹżK= £ØÓĆŗ¬K1”¢K2”¢K3µÄ“śŹżŹ½±ķŹ¾£©£»
£Ø3£©ĻĀĮŠ“ėŹ©ÖŠ£¬ÄÜĢįøßCH3OCH3²śĀŹµÄÓŠ £»
A£®·ÖĄė³ö¶ž¼×ĆŃ B£®ÉżøßĪĀ¶Č
C£®øÄÓĆøߊ§“߻ƼĮ D£®Ōö“óŃ¹Ēæ
£Ø4£©¹¤ŅÕÖŠ·“Ó¦¢ŁŗĶ·“Ó¦¢Ś·Ö±šŌŚ²»Ķ¬µÄ·“Ó¦Ę÷ÖŠ½ųŠŠ£¬ĪŽ·“Ó¦¢Ū·¢Éś£®øĆ¹¤ŅÕÖŠ·“Ó¦¢ŪµÄ·¢ÉśĢįøßĮĖCH3OCH3µÄ²śĀŹ£¬ŌŅņŹĒ £»
£Ø5£©ŅŌn£ØH2£©/n£ØCO£©=2 ĶØČė1LµÄ·“Ó¦Ę÷ÖŠ£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗ4H2£Øg£©+2CO£Øg£©![]() CH3OCH3£Øg£©+H2O£Øg£©”÷H£¬ĘäCOµÄĘ½ŗā×Ŗ»ÆĀŹĖęĪĀ¶Č”¢Ń¹Ēæ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ £»
CH3OCH3£Øg£©+H2O£Øg£©”÷H£¬ĘäCOµÄĘ½ŗā×Ŗ»ÆĀŹĖęĪĀ¶Č”¢Ń¹Ēæ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ £»
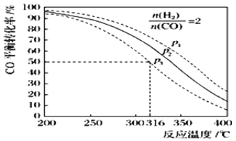
A£®øĆ·“Ó¦µÄ”÷H£¾0
B£®ČōŌŚp2ŗĶ316”ꏱ·“Ó¦“ļµ½Ę½ŗā£¬ŌņCOµÄ×Ŗ»ÆĀŹŠ”ÓŚ50%
C£®ČōŌŚp3ŗĶ316”ꏱ·“Ó¦“ļµ½Ę½ŗā£¬H2µÄ×Ŗ»ÆĀŹµČÓŚ50%
D£®ČōŌŚp3ŗĶ316”ꏱ£¬ĘšŹ¼Ź±n£ØH2£©/n£ØCO£©=3£¬Ōņ“ļĘ½ŗāŹ±COµÄ×Ŗ»ÆĀŹ“óÓŚ50%
E£®ČōŌŚp1ŗĶ200”ꏱ£¬·“Ó¦“ļĘ½ŗāŗó±£³ÖĪĀ¶ČŗĶŃ¹Ēæ²»±ä£¬ŌŁ³äČė2mol H2ŗĶ1mol CO£¬ŌņĘ½ŗāŹ±¶ž¼×ĆѵÄĢå»ż·ÖŹżŌö“ó
£Ø6£©Ä³ĪĀ¶ČĻĀ£¬½«8.0mol H2ŗĶ4.0mol CO³äČėČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦£ŗ4H2£Øg£©+2CO£Øg£©CH3OCH3£Øg£©+H2O£Øg£©£¬·“Ó¦“ļĘ½ŗāŗó²āµĆ¶ž¼×ĆѵÄĢå»ż·ÖŹżĪŖ25%£¬ŌņøĆĪĀ¶ČĻĀ·“Ó¦µÄĘ½ŗā³£ŹżK= £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ×é³ÉĻø°ūµÄ»ÆѧŌŖĖŲÖŠ±»³ĘĪŖ×ī»ł±¾ŌŖĖŲµÄŹĒ
A. C B. H C. O D. N
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ1.0 LĆܱÕČŻĘ÷ÖŠ·ÅČė0.10 mol X£¬ŌŚŅ»¶ØĪĀ¶ČĻĀ·¢Éś·“Ó¦£ŗX(g)![]() Y(g)£«Z(g) H£¼0ČŻĘ÷ÄŚĘųĢå×ÜŃ¹ĒæpĖę·“Ó¦Ź±¼ätµÄ±ä»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£ŅŌĻĀ·ÖĪöÕżČ·µÄŹĒ
Y(g)£«Z(g) H£¼0ČŻĘ÷ÄŚĘųĢå×ÜŃ¹ĒæpĖę·“Ó¦Ź±¼ätµÄ±ä»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£ŅŌĻĀ·ÖĪöÕżČ·µÄŹĒ
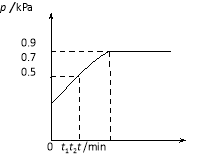
A£®“Ó·“Ó¦æŖŹ¼µ½t1Ź±µÄĘ½¾ł·“Ó¦ĖŁĀŹ
v(X)£½![]() mol/(L”¤min)
mol/(L”¤min)
B£®øĆĪĀ¶ČĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżK£½0.32
C£®ÓūĢįøßĘ½ŗāĢåĻµÖŠYµÄŗ¬Į棬æÉÉżøßĢåĻµĪĀ¶Č»ņ¼õÉŁZµÄĮæ
D£®ĘäĖūĢõ¼ž²»±ä£¬ŌŁ³äČė0.1 mol ĘųĢåX£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬XµÄ×Ŗ»ÆĀŹŌö“ó
²éæ““š°øŗĶ½āĪö>>
¹ś¼ŹŃ§Š£ÓÅŃ” - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com