
【题目】在1.0 L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
Y(g)+Z(g) H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
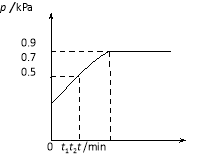
A.从反应开始到t1时的平均反应速率
v(X)=![]() mol/(L·min)
mol/(L·min)
B.该温度下此反应的平衡常数K=0.32
C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
【答案】B
【解析】
试题分析:A、根据阿伏加德罗定律:在相同的温度和体积下,气体的压强之比等于物质的量之比。设反应进行到t1时容器内气体的总物质的量为x,则x:0.10mol=0.7:0.5,解得x=0.14mol,气体的物质的量增加0.04mol,结合反应利用差量法分析,参加反应的X的物质的量为0.04mol,则从反应开始到t1时的平均反应速率v(X)=0.04/t1 mol/(L·min),错误; B、根据阿伏加德罗定律:在相同的温度和体积下,气体的压强之比等于物质的量之比。设反应达到平衡时容器内气体的总物质的量为x,则x:0.10mol=0.9:0.5,解得x=0.18mol,气体的物质的量增加0.08mol,结合反应利用差量法分析,参加反应的X的物质的量为0.08mol,生成Y和Z的物质的量均为0.08mol,容器的体积为1L,反应达平衡时,X、Y、Z的浓度分别为0.02mol/L、0.08mol/L、0.08mol/L,所以K=0.32,正确;C、该反应为放热反应,升高温度,平衡逆向移动,Y含量降低,错误;D、该反应为以X气体为反应物的分解反应,正反应为气体体积增大的反应,恒容容器中,平衡时再充入X,相当于增大压强,平衡逆向移动,X转化率降低,错误。


科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如下图所示:

(1)此反应的化学方程式中=___________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________________________。
(3)下列叙述能说明上述反应达到平衡状态的是_________(填字母序号)。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )
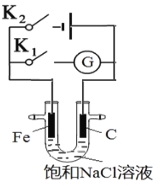
A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成物的总能量大于反应物总能量的是 ( )
A. 氢气在氧气中燃烧 B. 氢气与氯气化合
C. 中和反应 D. 焦炭在高温下与水蒸气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量的盐酸,这种试剂是
A.NH3·H2O
B.NaOH
C.Na2CO3
D.MgCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A. 电离能最小的电子能量最高
B. 在离核最近区域内运动的电子能量最低
C. 最易失去的电子能量最高
D. p轨道电子能量一定高于s轨道电子能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.在同温同压下,甲容器中的氧气(O2)和乙容器中的氨气(NH3)所含的原子个数相同,则甲、乙两容器中气体的体积之比为1:2
B.任何条件下,等物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等
C.在标准状况时,20mL NH3与60mL N2所含的原子个数比为1:3
D.同温同压下,1L一氧化碳气体一定比1L氧气的质量小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com