
ЁОЬтФПЁПГ§ШЅПеЦјжаЕФЖўбѕЛЏСђКЭАБбѕЛЏЮяЦјЬхЖдЛЗОГБЃЛЄгаживЊвтвхЁЃ
ЃЈ1ЃЉЖўбѕЛЏСђвзШмгкЫЎЃЌШмгкЫЎКѓЫљЕУШмвКжаH2SO3ЁЂHSO3-КЭSO32- еМШ§жжСЃзгзмЪ§ЕФБШР§ЫцpHЕФБфЛЏШчЯТЭМЫљЪОЁЃгЩЭМПЩжЊH2SO3 ЕФЕчРыЦНКтГЃЪ§Ka1=____________ЁЃ

ЃЈ2ЃЉРћгУФђЫи[COЃЈNH2ЃЉ2]ЫЎНтЕФШмвКПЩвдЮќЪеКЌSO2 ЕФПеЦјЁЃвбжЊФђЫиЫЎНтЗХШШЃЌГЃЮТЯТЫЎНтЗДгІНЯТ§ЃЌЫЎНтЕФЗДгІЗНГЬЪНШчЯТ:COЃЈNH2ЃЉ2+H2O=H2NCOONH4ЃЈАБЛљМзЫсяЇЃЉЁЃ
ЂйАБЛљМзЫсяЇЛсгыПеЦјжаЕФSO2 КЭO2 ЗДгІЩњГЩЃЈNH4ЃЉ2SO4,ИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________ЁЃ
ЂквЛЖЈЬѕМўЯТ,гУФђЫиШмвКЮќЪеКЌSO2 ЕФПеЦјЃЌВтЕУSO2 ЕФЮќЪеТЪЫцШмвКЕФЮТЖШБфЛЏШчЭММзЫљЪОЁЃЮТЖШИпгк60 ЁцЪБЃЌSO2 ЕФЮќЪеТЪж№НЅЩ§ИпЕФдвђЪЧ_____________ЁЃ
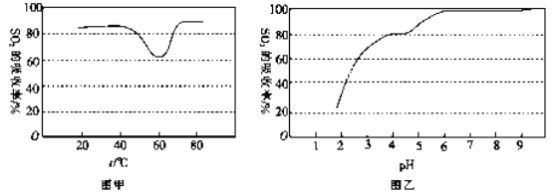
ЂлФђЫиШмвКЮќЪеSO2 ЕФЮќЪеТЪЫцШмвКЕФpHБфЛЏШчЭМввЫљЪОЁЃФђЫиШмвКЮќЪеКЌSO2ЕФПеЦјКѓШмвКЕФpHЛсНЕЕЭЃЌЮЊЬсИпSO2 ЕФЮќЪеТЪКЭГфЗжЛиЪеВњЮяЃЌзюКУЯђШмвКжаМгШы_____ЃЈЬюШмвКЕФУћГЦЃЉВЂПижЦpH ЮЊ_______ЁЃ
ЃЈ3ЃЉвЛжжЕчЛЏбЇЭбЯѕЗЈЕФдРэШчЭМЫљЪОЁЃ
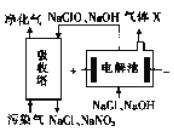
ЂйЕчНтГивѕМЋЫљЗЂЩњЕФЕчМЋЗДгІЮЊ_____________ЁЃ
ЂкЯрЭЌЬѕМўЯТЭЈШыЕФЮлШОЦјКЭЩњГЩЕФX ЕФЬхЛ§БШЮЊ40 :3,ЮлШОЦјжаNO КЭNO2 еМзмЬхЛ§ЕФ10%ЃЌШєNaClOЭъШЋЗДгІЃЌЮлШОЦјжаNOКЭNO2 БЛЭъШЋЮќЪеЧвЦфгрЦјЬхВЛВЮгыЗДгІЃЌдђNOКЭNO2 ЕФЬхЛ§БШЮЊ________ЁЃ
ЁОД№АИЁП 10-1.87 2H2NCOONH4+2SO2+O2+2H2O=2ЃЈNH4ЃЉ2 SO4+2CO2Ёќ ЮТЖШЩ§ИпЃЌФђЫиЫЎНтЩњГЩАБЛљМзЫсяЇИќПь АБЫЎ 6 2H2O +2e- =H2Ёќ+2OH- 1:3
ЁОНтЮіЁП(1)ИљОнЭМЯёЃЌдкpH=1.87ЪЧЃЌc(HSO3-)= c(H2SO3)ЃЌH 2SO3ЕФЕчРыЦНКтГЃЪ§Ka1=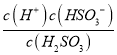 = c(H+)=10-1.87ЃЌЙЪД№АИЮЊЃК10-1.87ЃЛ
= c(H+)=10-1.87ЃЌЙЪД№АИЮЊЃК10-1.87ЃЛ
(2)ЂйАБЛљМзЫсяЇ(H2NCOONH4)ЛсгыПеЦјжаЕФSO2КЭO2ЗДгІЩњГЩ(NH4)2SO4ЃЌH2NCOONH4БЛбѕЛЏЮЊЖўбѕЛЏЬМЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ2H2NCOONH4+2SO2+O2+2H2O=2(NH4)2 SO4+2CO2ЁќЃЌЙЪД№АИЮЊЃК2H2NCOONH4+2SO2+O2+2H2O=2(NH4)2 SO4+2CO2ЁќЃЛ
ЂкФђЫиЫЎНтЗХШШЃЌГЃЮТЯТЫЎНтЗДгІНЯТ§ЃЌЫЎНтЕФЗДгІЗНГЬЪНШчЯТ:CO(NH2)2+H2O=H2NCOONH4(АБЛљМзЫсяЇ)ЃЌЮТЖШЩ§ИпЃЌФђЫиЫЎНтЩњГЩАБЛљМзЫсяЇМгПьЃЌЪЙЕУSO2ЕФЮќЪеТЪЩ§ИпЃЌЙЪД№АИЮЊЃКЮТЖШЩ§ИпЃЌФђЫиЫЎНтЩњГЩАБЛљМзЫсяЇИќПьЃЛ
ЂлФђЫиШмвКЮќЪеSO2ЕФЮќЪеТЪЫцШмвКЕФpHБфЛЏШчЭМввЫљЪОЁЃФђЫиШмвКЮќЪеКЌSO2ЕФПеЦјКѓШмвКЕФpHЛсНЕЕЭЃЌИљОнЭМЯёЃЌШмвКЕФpHЁн6ЪЙЃЌSO2ЕФЮќЪеТЪНЯИпЃЌвђДЫашвЊПижЦдк6зѓгвЃЌашвЊМгШыМюадЮяжЪЕїНкШмвКЕФpHЃЌЮЊСЫВЛв§ШыаТдгжЪЃЌПЩвдбЁгУАБЫЎЕїНкЃЌЙЪД№АИЮЊЃКАБЫЎЃЛ6ЃЛ
(3)ЂйИљОнЭМЪОЃЌЕчНтТШЛЏФЦКЭЧтбѕЛЏФЦЕФЛьКЯШмвКЃЌбєМЋЩЯШмвКжаЕФТШРызгЗХЕчЩњГЩДЮТШЫсИљРызгЃЌвѕМЋЩЯШмвКжаЕФЧтРызг(ЫЎЕчРыЩњГЩЕФ)ЗХЕчЩњГЩЧтЦјЃЌвђДЫвѕМЋЕФЕчМЋЗДгІЮЊ2H2O +2e- =H2Ёќ+2OH-ЃЌЙЪД№АИЮЊЃК2H2O +2e- =H2Ёќ+2OH-ЃЛ
ЂкЕчНтЕФзмЗДгІЗНГЬЪНЮЊCl-+ H2O ![]() ClO-+ H2ЁќЃЌЯрЭЌЬѕМўЯТЭЈШыЕФЮлШОЦјКЭЩњГЩЕФXЕФЬхЛ§БШЮЊ40:3ЃЌМйЩшЩњГЩЕФЧтЦјЮЊ3molЃЌдђЭЈШыЕФЮлШОЦјЮЊ40molЃЌЦфжаКЌгаNOКЭNO2ЕФЮяжЪЕФСПжЎКЭЮЊ4molЃЌЩњГЩ3molЧтЦјЃЌзЊвЦЕФЕчзгЮЊ6molЃЌИљОнЕУЪЇЕчзгЪиКуЃЌNOКЭNO2зЊвЦЕФЕчзгвВЪЧ6molЃЌЩшNOКЭNO2ЕФЮяжЪЕФСПЗжБ№ЮЊxЁЂyЃЌдђx+y=4molЃЌ3x+y=6molЃЌНтЕУx=1molЃЌy=3molЃЌдђNOКЭNO2ЕФЬхЛ§БШ=NOКЭNO2ЕФЬхЮяжЪЕФСПБШ=1:3ЃЌЙЪД№АИЮЊЃК1:3ЁЃ
ClO-+ H2ЁќЃЌЯрЭЌЬѕМўЯТЭЈШыЕФЮлШОЦјКЭЩњГЩЕФXЕФЬхЛ§БШЮЊ40:3ЃЌМйЩшЩњГЩЕФЧтЦјЮЊ3molЃЌдђЭЈШыЕФЮлШОЦјЮЊ40molЃЌЦфжаКЌгаNOКЭNO2ЕФЮяжЪЕФСПжЎКЭЮЊ4molЃЌЩњГЩ3molЧтЦјЃЌзЊвЦЕФЕчзгЮЊ6molЃЌИљОнЕУЪЇЕчзгЪиКуЃЌNOКЭNO2зЊвЦЕФЕчзгвВЪЧ6molЃЌЩшNOКЭNO2ЕФЮяжЪЕФСПЗжБ№ЮЊxЁЂyЃЌдђx+y=4molЃЌ3x+y=6molЃЌНтЕУx=1molЃЌy=3molЃЌдђNOКЭNO2ЕФЬхЛ§БШ=NOКЭNO2ЕФЬхЮяжЪЕФСПБШ=1:3ЃЌЙЪД№АИЮЊЃК1:3ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЃЫЎЕФзлКЯРћгУПЩвджЦБИН№ЪєУОЃЌЦфСїГЬШчЯТЭМЫљЪОЃК
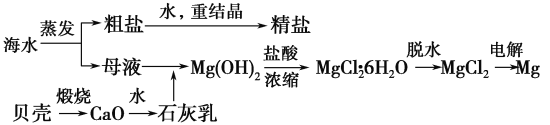
(1)Mg(OH)2ГСЕэжаЛьгаЕФCa(OH)2гІдѕбљГ§ШЅЃПаДГіЪЕбщВНжшЁЃ_______________________
(2)ЪЕбщЪвНЋДжбЮжЦГЩОЋбЮЕФЙ§ГЬжаЃЌШмНтЁЂЙ§ТЫЁЂеєЗЂШ§ИіВНжшЕФВйзїЖМвЊгУЕНВЃСЇАєЃЌЗжБ№ЫЕУїдкетШ§жжЧщПіЯТЪЙгУВЃСЇАєЕФФПЕФЃК
ЂйШмНтЃК_____________________________ЁЃ
ЂкЙ§ТЫЃК_____________________________ЁЃ
ЂлеєЗЂЃК_____________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк2 LУмБеШнЦїФкЃЌМгШы0.100 molCOЦјЬхКЭ0.080 molCuOЙЬЬхЃЌ800ЁцЪБЗЂЩњШчЯТЗДгІЃК2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g)ЃЌn(CuO)ЫцЪБМфЕФБфЛЏШчБэЃК
Cu2O(s)+CO2(g)ЃЌn(CuO)ЫцЪБМфЕФБфЛЏШчБэЃК
ЪБМф(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)гУCOБэЪОЧА2minФкЕФЛЏбЇЗДгІЫйТЪ=________ЁЃ
(2)МЦЫуДЫЗДгІдк800CЪБЕФЛЏбЇЦНКтГЃЪ§k=______________ЁЃШєЯђЦНКтКѓЕФЬхЯЕжаМгШыCOКЭCO2Иї0.05molЃЌдђДЫЪБv(е§)_______v (Фц) ЁЃ
(3)гУРДЛЙдCuOЕФCOПЩвдгУCКЭЫЎеєЦјЗДгІжЦЕУЁЃ
вбжЊЃКC(s)+O2(g)![]() CO2(g) H =-393.5 kJ/molЃЌ2CO(g)+ O2(g)
CO2(g) H =-393.5 kJ/molЃЌ2CO(g)+ O2(g)![]() 2CO2(g) H=-566 kJ/molЃЌ2H2(g)+ O2(g)
2CO2(g) H=-566 kJ/molЃЌ2H2(g)+ O2(g)![]() 2H2O(g) H =-571.6 kJ/molЃЌдђC(s)ЃЋH2O(g)
2H2O(g) H =-571.6 kJ/molЃЌдђC(s)ЃЋH2O(g)![]() CO(g)ЃЋH2(g) H = __________ЁЃДЫЗДгІЕФЛЏбЇЦНКтБэДяЪНЮЊЃК_______________________ЁЃ
CO(g)ЃЋH2(g) H = __________ЁЃДЫЗДгІЕФЛЏбЇЦНКтБэДяЪНЮЊЃК_______________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪЃКЂйДПМюЂкЪГбЮЫЎЂлПеЦјЂмЩеМюЂнвКТШЂоЯѕЫсМиЃЌЗжРрШЋе§ШЗЕФЪЧЃЈ ЃЉ
A.МюЁЊЁЊЂйЂмB.ЕчНтжЪЁЊЁЊЂлЂмЂнC.ЛьКЯЮяЁЊЁЊЂкЂлD.бЮЁЊЁЊЂкЂо
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЯТСаНсЙЙЕФЮяжЪЃКЂйCH3(CH2)3CH3
ЂкCH3CH2CH2CH2CH3
ЂлCH3CH2CH2CH2CH2CH3
Ђм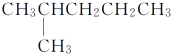
Ђн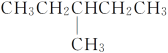
Ђо
Ђп
ЦфжаЃЌЪєгкЭЌЯЕЮяЕФЪЧ________ЃЛЪєгкЭЌЗжвьЙЙЬхЕФЪЧ__________ЃЛЪєгкЭЌжжЮяжЪЕФЪЧ________ЁЃ
AЂйЂк BЂкЂл CЂлЂмЂнЂоЂп DЂйЂл EЂлЂмЂнЂп FЂмЂо
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЖўбѕЛЏЙшЁЂЖўбѕЛЏСђКЭЖўбѕЛЏЬМЖМЪЧЫсадбѕЛЏЮяЃЌЛЏбЇаджЪОпгавЛЖЈЕФЯрЫЦадЃЌУОКЭФЦЕФЛЏбЇаджЪвВОпгавЛЖЈЕФЯрЫЦадЁЃ

гУШчЩЯЭМЫљЪОзАжУНјааУОКЭЖўбѕЛЏСђЕФЪЕбщЃЌЦфжаAЪЧжЦБИЖўбѕЛЏСђЕФЗЂЩњзАжУЁЃ
ЃЈ1ЃЉбЁдёжЦШЁЖўбѕЛЏСђЕФКЯЪЪЪдМС________(ЬюађКХ)ЁЃ
Ђй10%ЕФСђЫсШмвКЁЁЂк80%СђЫсШмвКЁЁЂлбЧСђЫсФЦЙЬЬхЁЁЂмбЧСђЫсИЦЙЬЬх
ЃЈ2ЃЉаДГізАжУBжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЃК ______________________ЁЃ
ЃЈ3ЃЉФуШЯЮЊИУзАжУЕФВЛзужЎДІЪЧ_______________________________(ШЮаД2Ьѕ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛ10 LЕФУмБеШнЦїжаГфШыSO2КЭO2,ЗЂЩњЗДгІ:2SO2(g)+O2(g)![]() 2SO3(g)ЁЃВтЕУ4 minФк,O2ЕФЮяжЪЕФСПгЩПЊЪМЕФ18 molНЕЕН14 mol,дйЙ§t min,O2ЕФЮяжЪЕФСПБфЮЊ10 molЁЃЧѓ:
2SO3(g)ЁЃВтЕУ4 minФк,O2ЕФЮяжЪЕФСПгЩПЊЪМЕФ18 molНЕЕН14 mol,дйЙ§t min,O2ЕФЮяжЪЕФСПБфЮЊ10 molЁЃЧѓ:
(1)4 minФЉSO3ЕФХЈЖШЁЃ
(2)4 minФкгУSO2БэЪОЕФЗДгІЫйТЪЁЃ
(3)t (ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)4 min,РэгЩЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввБН( )ЪЧживЊЕФЛЏЙЄдСЯЃЌЙЄвЕЩЯРћгУввБНПЩвджЦБИБНввЯЉКЭІТ-ТШБНввЭщ:
)ЪЧживЊЕФЛЏЙЄдСЯЃЌЙЄвЕЩЯРћгУввБНПЩвджЦБИБНввЯЉКЭІТ-ТШБНввЭщ:
ввБНЭбЧтжЦБНввЯЉ:
![]() ЁїH1=akJ/mol
ЁїH1=akJ/mol
ввБНТШЛЏжЦІТ-ТШБНввЭщ:
![]() ЁїH2=bkJ/mol
ЁїH2=bkJ/mol
ЛиД№ЯТСаЮЪЬт:
(1)РћгУЯТБэЬсЙЉЕФЪ§ОнМЦЫуa=_____ЁЃввБНЭбЧтжЦБНввЯЉЕФЗДгІдк_____(ЬюЁАИпЮТЁБЛђЁАЕЭЮТЁБ)гаРћгкЦфздЗЂНјааЁЃ
ЛЏбЇМќ | C-H | C-C | H-H | C=C |
МќФм/kJ/mol | 412 | 348 | 436 | 612 |
(2)вбжЊ
![]() +HCl(g)
+HCl(g)![]()
![]() ЁїH=-54kJ/mol
ЁїH=-54kJ/mol
H2(g)+Cl2(g)=2HCl(g) ЁїH=-185kJ/mol дђb=______________ЁЃ
(3)TЁцЃЌНЋnmolввБНМгШыЕНЬхЛ§ЮЊV LЕФКуШнШнЦїжаЃЌЗЂЩњЭбЧтЗДгІЃЌШнЦїФкбЙЧПЫцЪБМфБфЛЏШчЯТБэЫљЪО:
ЪБМф/min | 0 | 10 | 20 | 30 | 40 |
бЙЧП/ЁС100 kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
ЦНКтЪБШнЦїФкЦјЬхЕФзмЮяжЪЕФСПЮЊ______ЃЌввБНЕФзЊЛЏТЪЮЊ______%ЁЃ
(4)ЙЄвЕгЩввБНЭбЧтжЦБНввЯЉЪЕМЪЩЯЪЧдкКубЙУмБеШнЦїжаНјааЕФЁЃНЋm molввБНЭЈШыФГКубЙУмБеШнЦїжа(ЗДгІЙ§ГЬжаЮЌГжбЙЧПЮЊp),ввБНЕФЦНКтзЊЛЏТЪЫцЮТЖШБфЛЏШчгвЭМЫљЪО:
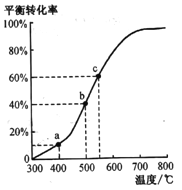
ЂйдкaЕуЫљЪОЕФЬѕМўЯТЃЌЯђИУШнЦїжаЭЈШы25LЫЎеєЦјЃЌдђввБНЕФзЊЛЏТЪ______(ЬюЁАБфДѓЁБЁАБфаЁЁБЛђВЛБф)ЃЌЩњГЩБНввЯЉЕФЫйТЪ________(ЬюЁАБфДѓЁБЁАБфаЁЁБЛђВЛБф)ЁЃ
ЂкbЕуЦјЬхзмЬхЛ§______(ЬюЁА<ЁБЁА>ЁБЛђЁА=ЁБ)c ЕуЦјЬхзмЬхЛ§ЁЃ
ЂлcЕуЦНКтГЃЪ§Kp=_______(гУЦНКтЗжбЙДњЬцЦНКтХЈЖШЃЌЦНКтЗжбЙ=ЮяжЪЕФСПЗжЪ§ЁСзмбЙ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЭЌбЇЩшМЦСЫШчЯТЪЕбщСїГЬ:дквЛИіаЁЩеБРя,МгШы20 g Ba(OH)2ЁЄ8H2OОЇЬхКЭ10 g NH4ClОЇЬх,ШЛКѓНЋаЁЩеБЗХдкЪТЯШвбЕЮга3~4ЕЮЫЎЕФВЃСЇЦЌЩЯ,ВЂСЂМДгУВЃСЇАєбИЫйНСАшЁЃЪЕбщСїГЬЪОвтЭМШчЯТ,ЛиД№ЯТСаЮЪЬт:
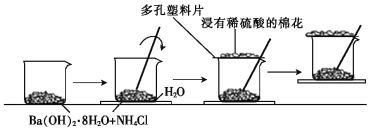
(1)ЪЕбщжаВЃСЇАєЕФзїгУЪЧ ЁЃ
(2)НўгаЯЁСђЫсЕФУоЛЈЕФзїгУЪЧ ЁЃ
(3)ЭЈЙ§ ЯжЯѓ,ЫЕУїИУЗДгІЮЊ (ЬюЁАЮќШШЁБЛђЁАЗХШШЁБ)ЗДгІ,етЪЧвђЮЊЗДгІЮяЕФзмФмСП (ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)ЩњГЩЮяЕФзмФмСПЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com