
【题目】如图为实验室制氯气的装置示意图,根据图示回答下列问题。
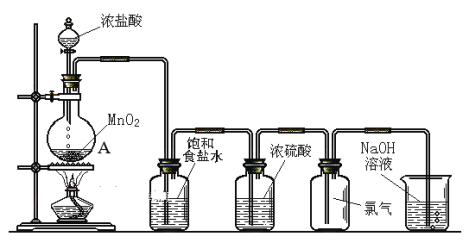
(1)写出MnO2和浓盐酸反应的化学方程式___________。
(2)A仪器的名称是___________;浓硫酸的作用___________。
(3)NaOH溶液的作用:___________;写出相关反应的化学方程式___________。
【答案】4HCl(浓)+MnO2![]() MnCl2+2H2O+Cl2↑圆底烧瓶 干燥Cl2(吸收水蒸气)尾气处理Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2+2H2O+Cl2↑圆底烧瓶 干燥Cl2(吸收水蒸气)尾气处理Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
二氧化锰和浓盐酸反应生成氯气,利用饱和食盐水除去氯化氢,浓硫酸干燥氯气,利用向上排空气法收集氯气,氢氧化钠溶液吸收氯气,据此解答。
(1)MnO2和浓盐酸在加热的条件下发生氧化还原反应生成氯气,反应的化学方程式为4HCl(浓)+MnO2![]() MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。
(2)A仪器的名称是圆底烧瓶,生成的氯气中含有氯化氢和水蒸气,饱和食盐水吸收氯化氢,浓硫酸吸收水蒸气,起干燥Cl2的作用。
(3)氯气有毒,需要尾气处理,NaOH溶液的作用是吸收氯气,防止污染空气,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。


科目:高中化学 来源: 题型:
【题目】近年来,我国在航空航天事业上取得了令人瞩目的成就,科学家在能量的转化,航天器的零排放作出了很大的努力,其中为了达到零排放的要求,循环利用人体呼出的CO2并提供O2,设计了一种装置(如图)实现了能量的转化,总反应方程式为2CO2=2CO+O2。关于该装置下列说法正确的是( )

A. 装置中离子交换膜为阳离子交换膜
B. 反应完毕,电解质溶液碱性减弱
C. N型半导体为阳极,P型半导体为阴极
D. CO2参与X电极的反应方程式:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力大于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列结构的物质:①CH3(CH2)3CH3
②CH3CH2CH2CH2CH3
③CH3CH2CH2CH2CH2CH3
④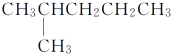
⑤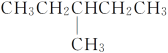
⑥
⑦
其中,属于同系物的是________;属于同分异构体的是__________;属于同种物质的是________。
A①② B②③ C③④⑤⑥⑦ D①③ E③④⑤⑦ F④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学利用注射器设计的简易实验装置。甲管中吸入10 mL CH4,同温同压下乙管中吸入50 mL Cl2,将乙管气体推入甲管中,将注射器用日光照射一段时间。
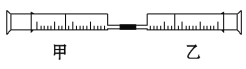
(1)下列是某同学预测的实验现象:
①气体最终变为无色;
②实验过程中,甲管活塞向内移动;
③甲管内壁有油珠;
④产生火花。
其中正确的是 。
(2)甲管中发生的化学反应类型为 。
(3)反应后,甲管中剩余气体最好用下列的 吸收。
A.水 B.氢氧化钠溶液
C.硝酸银溶液 D.饱和食盐水
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到 ,若用pH试纸测量甲管中溶液的酸碱性,可观察到pH试纸变 色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一10 L的密闭容器中充入SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。测得4 min内,O2的物质的量由开始的18 mol降到14 mol,再过t min,O2的物质的量变为10 mol。求:
2SO3(g)。测得4 min内,O2的物质的量由开始的18 mol降到14 mol,再过t min,O2的物质的量变为10 mol。求:
(1)4 min末SO3的浓度。
(2)4 min内用SO2表示的反应速率。
(3)t (填“>”“<”或“=”)4 min,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
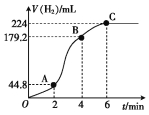
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应:2SO2+O2![]() 2SO3在不同条件下达到平衡状态时SO2的转化率。
2SO3在不同条件下达到平衡状态时SO2的转化率。
压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
试回答下列问题。
(1)关于可逆反应的限度,你能得出什么启示?
________________________________________。
(2)提高该化学反应限度的途径有:_____________________。
(3)要实现SO2的转化率为93.5%,需控制的反应条件是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1 mol/L NaOH溶液滴入20.00 mL 0.1 mol/L HA溶液,溶液pH随加入NaOH溶液体积的变化曲线如图所示。
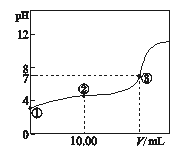
其中不正确的是 ( )
A. ①点:由水电离出的c(H+)=1×10-3mol/L
B. ②点:c(A-)>c(Na+)>c(H+)>c(OH-)
C. ③点:c(Na+)=c(A-)>c(H+)=c(OH-)
D. ③点加入NaOH溶液的体积小于20.00mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com