
����Ŀ����ͼ��ijͬѧ����ע������Ƶļ���ʵ��װ�á���������10 mL CH4,ͬ��ͬѹ���ҹ�������50 mL Cl2,���ҹ������������,��ע�������չ�����һ��ʱ�䡣
(1)������ijͬѧԤ���ʵ������:
���������ձ�Ϊ��ɫ;
��ʵ�������,�ܻ��������ƶ�;
�ۼ��ڱ�������;
�ܲ�����
������ȷ���� ��
(2)���з����Ļ�ѧ��Ӧ����Ϊ ��
(3)��Ӧ��,����ʣ��������������е� ���ա�
A.ˮ B.����������Һ
C.��������Һ D.����ʳ��ˮ
(4)��Ӧ��,�������е���������ʢ������AgNO3��Һ��С�Թ��л�۲쵽 ,����pH��ֽ����������Һ�������,�ɹ۲쵽pH��ֽ�� ɫ��
���𰸡�(1)�ڢ� (2)ȡ����Ӧ (3)B
(4)Һ���Ϊ����,������ɫ���� ��
���������ڹ�����,��������������������Ӧ:
CH4+Cl2![]() CH3Cl+HCl,
CH3Cl+HCl,
CH3Cl+Cl2![]() CH2Cl2+HCl,
CH2Cl2+HCl,
CH2Cl2+Cl2![]() CHCl3+HCl,
CHCl3+HCl,
CHCl3+Cl2![]() CCl4+HCl��
CCl4+HCl��
(1)������,���������������Ϊ1��4ʱ����ǡ����ȫ��Ӧ,����ע��������������������Ϊ5��1>4��1,˵����������,���������������������÷�Ӧ���л���,���������������ֻ���Ȼ����һ�ȼ���Ϊ����,��������������ʵ�����С,�ڲ�ѹǿ��С,�ܻ��������ƶ���
(2)��������е��ĸ���ԭ�ӿɱ���ԭ����һȡ��,�ʼ��з�������ȡ����Ӧ��
(3)ʣ�������к����������Ȼ���,��������������Һ����ʣ�����塣
(4)���ɵ�HCl����AgNO3��Ӧ����AgCl��ɫ����,ͬʱ��CH2Cl2��CHCl3��CCl4������ˮ������Һ���Ϊ����,��Һ������,pH��ֽ��Ϊ��ɫ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
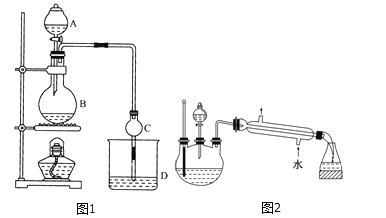
����Ŀ��ij����С����Ƶ�ʵ������ȡ����������װ����ͼ1��ʾ��A�з���Ũ���ᣬB�з�����ˮ�Ҵ�����ˮ�����ƣ�D�з��б���̼������Һ��
��֪������ˮ�Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl26C2H5OH��
���й��л���ķе㣺
�Լ� | ���� | �Ҵ� | ���� | �������� |
�е�/�� | 34.7 | 78.5 | 118 | 77.1 |
��ش�
��1��Ũ�����������__________������ͬλ��18Oʾ�ٷ�ȷ����Ӧ����ˮ��������ԭ�ӵ��ṩ�ߣ�д���ܱ�ʾ18Oλ�õĻ�ѧ����ʽ��__________��
��2�����θ����C��������__________������Ӧǰ��D�м��뼸�η�̪����Һ�ʺ�ɫ����Ӧ������D�е�������__________��
��3�����÷�Һ����D�з���������������г�����һ�������Ҵ������Ѻ�ˮ��Ȼ�������ˮ�Ȼ��ƣ������__________���ټ�����ˮ�����Ƴ�ȥˮ��Ȼ�����__________����������ƣ����Եýϴ���������������
��4������ʵ���б���̼������Һ��������______(����ĸ����)��
A����Ӧ��������Ҵ�
B����Ӧ�����Ტ���ղ����Ҵ�
C�����������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�еĸ�С�������ڷֲ�����
D�������������ɣ���������
��5����һ��ѧ����С�������ʵ������˸Ľ��������ͼ2��ʾ��װ�ã�����Ũ���ᡢ�Ҵ���������ȡ��������(����̨�����С�����װ�þ�����ȥ)��ͼ1��ʾװ����ȣ���װ�õ���Ҫ�ŵ��У�д��һ�����ɣ�__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
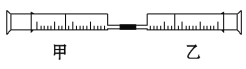
����Ŀ����ͼ��A���ӵ����ģ�ͺ�B���ӵı���ģ��,�ش���������:

(1)A��B�Ĺ�ϵ�� ��
(2)д��A�����ڴ������������¼��Ⱥ�������Ӧ�Ļ�ѧ����ʽ ��
(3)д��B���Ӻͽ����Ʒ�Ӧ�Ļ�ѧ����ʽ ��
(4)B�ڼ����������ܹ���HBr������Ӧ����������,�÷�Ӧ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾʵ��װ�ã��ش��������⣺
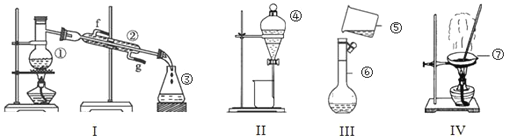
��1��д���������������ƣ���_________����_________����__________��
��2������������ʵ��֮ǰ����װ���Ƿ��©ˮ����______________�����������ƣ���
��3��ʵ��������18mol/LŨ��������100mL 3mol/Lϡ���ᣬ������Ũ����������____mL������һλС��������ȡŨ����������Ͳ�Ĺ����____��ѡ�10mL������25mL����50mL��������ʵ�������ҡ�ȹ����У������������Σ���ʱӦ��ȡ�Ĵ�ʩ��_______���������Ƶ�ϡ����Ũ��ƫ�������п��ܵ�ԭ���������ȷ����_______��
A������ǰ������ƿ������������ˮ B����ȡŨ����ʱ������Һ��İ�Һ��
C��δ��ȴ������ת��������ƿ���� D������ʱ��������Һ�İ�Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���������е�����Ϊ42��
(1)�������ķ���ʽΪ______________________��
(2)д�����������ӵ�����ͬ���칹��Ľṹ��ʽ______________________��
(3)����ͬ���칹���У�����ͬ�����·е���͵���_____________________��(д�ṹ��ʽ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������������װ��ʾ��ͼ������ͼʾ�ش��������⡣
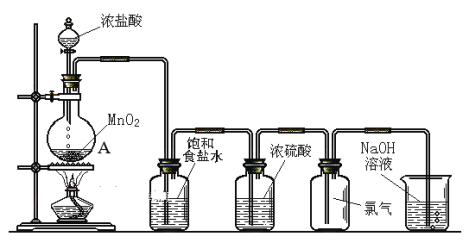
��1��д��MnO2��Ũ���ᷴӦ�Ļ�ѧ����ʽ___________��
��2��A������������___________��Ũ���������___________��
��3��NaOH��Һ�����ã�___________��д����ط�Ӧ�Ļ�ѧ����ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.4 mol X�����0.6 mol Y��������2 L�ܱ�������,������Ӧ:4X(g)+5Y(g)![]() nZ(g)+6W(g)��2 minĩ����0.3 mol W,�������Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����v(Z)=0.05 mol��L-1��min-1,����:
nZ(g)+6W(g)��2 minĩ����0.3 mol W,�������Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����v(Z)=0.05 mol��L-1��min-1,����:
(1)ǰ2 min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����;
(2)2 minĩʱY��Ũ��;
(3)��ѧ��Ӧ����ʽ��n��ֵ�Ƕ���?
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2S2O3��5H2O��������ϴ�����Ƭ�Ķ�Ӱ����ʵ������Na2S��Na2CO3��SO2Ϊԭ�ϣ�������ͼװ�ÿ���ȡ����Na2S2O3��5H2O����ʵ��ԭ��ΪNa2CO3+SO2=Na2S2O3+CO2��2Na2S+3SO2==2Na2SO3+3S��Na2SO3+S=Na2S2O3���ش���������:
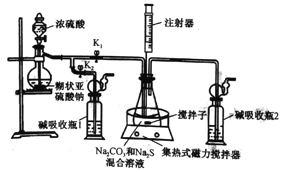
(1)��K1���ر�K2������ƿ�е���Һ������35������Һ©�����������μ�Ũ���ᣬ��ƿ�е�������: �����ܿ�������ð������__________________��
(2)ͨ��ע����ȡ���������ƿ����ҺpH=7��8����ƿ�����Բ��ܹ�ǿ��ԭ����_______������ƿ����Һ��pH�ӽ�7ʱ��Ӧ���еIJ�����__________________________��
(3)��Ӧ��������ƿ�л��Һ�����´�����Na2S2O3��5H2O�־���:
![]()
�ٳ��ȹ��˵�Ŀ����______________________��
�ڴ־����к���Na2CO3��Na2SO3��Na2SO4������,���������ṩ���Լ�������ֲ�Ʒ�к���Na2CO3��
��ѡ�Լ�: a.Ʒ����Һ b.���Ը��������Һ c.����ʯ��ˮ d.NaOH��Һ e.ϡ����
ʵ�鷽��:ȡ�������ô־��������Һ���μ�������ϡ���ᣬ����������������ͨ�����Ը��������Һ��_____(���Լ����)������ʯ��ˮ����______(������),��֤����Ʒ�к���Na2CO3��
(4)�־�����Na2S2O3��5H2O���������IJⶨ:��ȡ2.500g�־�������ˮ�����100mL��Һ��ȡ25.00mL��Һ����ƿ��,��0.4000 mol/L�����Ը�����ر���Һ�ζ�,���ı���Һ�����Ϊ10.00mL��Na2S2O3��5H2O����������Ϊ______ (�������ʶԵζ���Ӱ�죻S2O32-�����Ը��������Һ����ΪSO42-)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com