
【题目】甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) ![]() CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1
(1)某研究小组,在温度和容器的容积保持不变时,研究该反应是否达到平衡状态,以下五位同学对平衡状态的描述正确的是__________。
A.甲:H2的消耗速率等于CH3OH的生成速率
B.乙:容器内的压强保持不变
C.丙:容器内气体的密度保持不变
D.丁:容器中气体的平均摩尔质量保持不变
(2)若在一定温度下、容积为2L的密闭容器中,投入2 mol CO、4 mol H2,保持恒温、恒容,测得反应达到平衡时H2转化率为75%,求平衡时CH3OH的浓度=__________mol/L
(3)已知在298K、101kPa下:甲醇的燃烧热化学方程式为:
CH3OH(l)+ 3/2 O2(g)= CO2(g)+ 2H2O(l) ΔH= -725.8 kJ·mol-1;
CO的燃烧热化学方程式为:CO(g)+ 1/2 O2(g)= CO2(g) ΔH= -283 kJ·mol-1;
H2O (g) === H2O(l) ΔH= -44 kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式__________。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)
①该电池中通入甲醇的是电源的__________(填正、负)极,若KOH溶液足量,则写出电池总反应的离子方程式__________。
②若电解质溶液中KOH的物质的量为0.5mol,当有0.5mol甲醇参与反应时,产物恰好为KHCO3时,该电池的负极反应式为__________,所得溶液中各种离子的物质的量浓度由大到小的顺序是__________。
【答案】 BD 0.75 mol/L CH3OH (l)+O2(g) = CO (g)+ H2O(g) ΔH= -354.8 kJ·mol-1 负 2CH3OH+3O2+4OH- = 2CO32-+6H2O CH3OH – 6e- + 7OH- = HCO3- + 5H2O c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
【解析】(1)A. H2的消耗速率不会等于CH3OH的生成速率,A错误;B. 若压强保持不变,则气体体积既不增加也不减少,方程处于平衡状态,B正确;C. 由于方程不论向那个方向进行,总质量不变,容器体积固定,则气体密度不发生改变,C错误;D. 方程式两端物质平均摩尔质量不同,若平均摩尔质量不变,则方程平衡,D正确。故选择BD。
(2)消耗75%的氢气,即消耗3mol氢气,生成甲醇1.5mol,则容器内甲醇的浓度为0.75 mol/L;
(3)反应方程为CH3OH (l)+O2(g) = CO (g)+ H2O(g),ΔH= [-725.8-(-283)-(-44)×2] kJ·mol-1 =-354.8 kJ·mol-1
(4)①因为氧气要在正极得到电子,所以甲醇在负极失去电子被氧化;离子方程式为:2CH3OH+3O2+4OH- = 2CO32-+6H2O;
②负极CH3OH失去电子,与KOH反应生成KHCO3,离子方程式为:CH3OH – 6e- + 7OH- = HCO3- + 5H2O;反应生成KHCO3,同时存在H2O+HCO3-===(可逆)CO32++2OH-,故溶液中的离子为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。


科目:高中化学 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力大于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
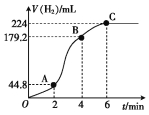
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应:2SO2+O2![]() 2SO3在不同条件下达到平衡状态时SO2的转化率。
2SO3在不同条件下达到平衡状态时SO2的转化率。
压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
试回答下列问题。
(1)关于可逆反应的限度,你能得出什么启示?
________________________________________。
(2)提高该化学反应限度的途径有:_____________________。
(3)要实现SO2的转化率为93.5%,需控制的反应条件是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是( )。

A.正极反应式:Ca+2Cl--2e-=CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正、负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着核电荷数的递增,氧化性逐渐减弱的一组是( )
A.I2、Br2、Cl2、F2B.F2、Cl2、Br2、I2C.F-、Cl-、Br-、I-D.Li、Na、K、Rb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1 mol/L NaOH溶液滴入20.00 mL 0.1 mol/L HA溶液,溶液pH随加入NaOH溶液体积的变化曲线如图所示。
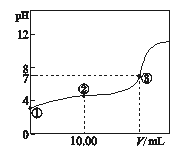
其中不正确的是 ( )
A. ①点:由水电离出的c(H+)=1×10-3mol/L
B. ②点:c(A-)>c(Na+)>c(H+)>c(OH-)
C. ③点:c(Na+)=c(A-)>c(H+)=c(OH-)
D. ③点加入NaOH溶液的体积小于20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检测熟肉中NaNO2含量,某兴趣小组从1 000 g 隔夜熟肉中提取NaNO3和NaNO2后配成溶液,用0.005 00 mol·L-1的高锰酸钾(酸性)溶液滴定。平行测定三次,求出每次NaNO2含量,取其平均值。(已知:2MnO![]() +5NO
+5NO![]() +6H+===2Mn2++5NO
+6H+===2Mn2++5NO![]() +3H2O)
+3H2O)
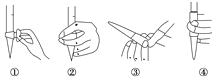
(1)滴定前排气泡时,应选择图中的________(填序号)。滴定时,高锰酸钾溶液盛放在___________________。
(2)滴定终点的判断依据为__________________________________。
(3)下列操作会导致样品含量测定值偏高的是__________________(填序号)。
a.锥形瓶用蒸馏水洗后未用待测液润洗
b.酸式滴定管用蒸馏水洗后未用标准液润洗
c.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
d.滴定前平视读数,滴定结束仰视读数
(4)某次滴定过程中,消耗高锰酸钾溶液的体积为16.00 mL。则此次求得的NaNO2的含量为________mg·kg-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com