
����Ŀ��Ϊ�˼��������NaNO2������ij��ȤС���1 000 g ��ҹ��������ȡNaNO3��NaNO2�������Һ����0.005 00 mol��L��1�ĸ������(����)��Һ�ζ���ƽ�вⶨ���Σ����ÿ��NaNO2������ȡ��ƽ��ֵ��(��֪��2MnO![]() ��5NO
��5NO![]() ��6H��===2Mn2����5NO
��6H��===2Mn2����5NO![]() ��3H2O)
��3H2O)
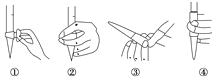
��1���ζ�ǰ������ʱ��Ӧѡ��ͼ�е�________(�����)���ζ�ʱ�����������Һʢ����___________________��
��2���ζ��յ���ж�����Ϊ__________________________________��
��3�����в����ᵼ����Ʒ�����ⶨֵƫ�ߵ���__________________(�����)��
a����ƿ������ˮϴ��δ�ô���Һ��ϴ
b����ʽ�ζ���������ˮϴ��δ�ñ�Һ��ϴ
c���ζ�����������ƿʱ��������������Һ����
d���ζ�ǰƽ�Ӷ������ζ��������Ӷ���
��4��ij�εζ������У����ĸ��������Һ�����Ϊ16.00 mL����˴���õ�NaNO2�ĺ���Ϊ________mg��kg��1��
���𰸡� �� ��ʽ�ζ��� ���������һ��(����)���������Һʱ����Һ��ɫ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ����Ϊ�ζ��յ� bd 13.8
�������������������1�����������Һ��ʴ��Ӧʢ����ʽ�ζ����У�Ϊ��ȷ�����ų����ݣ�������ס��ʽ�ζ��ܻ�����������2������ĸ��������Һ������ɫʱ�ﵽ�ζ��յ㣻��3������ �����������4������2MnO
�����������4������2MnO![]() ��5NO
��5NO![]() ��6H��===2Mn2����5NO
��6H��===2Mn2����5NO![]() ��3H2O�������ĸ��������Һ�����Ϊ16.00 mLʱ��NaNO2��������
��3H2O�������ĸ��������Һ�����Ϊ16.00 mLʱ��NaNO2��������
��������1�����������Һ�ܸ�ʴ�����Ը��������Һʢ����ʽ�ζ����У�Ϊ��ȷ�����ų����ݣ�������ס��ʽ�ζ��ܻ�������������Ӧѡ��ͼ�е��ڣ���2���ζ��յ�ʱ�����������Һ����ȫ���ģ����������һ��(����)���������Һʱ����Һ��ɫ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ����Ϊ�ζ��յ�����3��a����ƿ������ˮϴ��δ�ô���Һ��ϴ����Ӱ��������a������b����ʽ�ζ���������ˮϴ��δ�ñ�Һ��ϴ����ҺŨ�ȱ�С�����ĸ��������Һ�����ƫ�ⶨֵƫ������b��ȷ��c���ζ�����������ƿʱ��������������Һ���������ĸ��������Һ�����ƫС���ⶨֵƫ������c������d���ζ�ǰƽ�Ӷ������ζ��������Ӷ��������������Һ�����ƫ�ⶨֵƫ������d��ȷ����4�����ĸ��������Һ�����Ϊ16.00 mL��n(KMnO4)=0.016L��0.005 00 mol��L��1=0.00008mol������2MnO![]() ��5NO
��5NO![]() ��6H��===2Mn2����5NO
��6H��===2Mn2����5NO![]() ��3H2O��n(NaNO2)= 0.00008mol��2��5=0. 0002mol�� NaNO2��������0.0138g=13.8mg��NaNO2�ĺ���Ϊ13.8mg��kg��1��
��3H2O��n(NaNO2)= 0.00008mol��2��5=0. 0002mol�� NaNO2��������0.0138g=13.8mg��NaNO2�ĺ���Ϊ13.8mg��kg��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ���CO��H2�ϳɼ״�������ΪCu2O/ZnO����CO(g)+2H2(g) ![]() CH3OH(g) ��H = -90.8 kJ��mol-1
CH3OH(g) ��H = -90.8 kJ��mol-1
��1��ij�о�С�飬���¶Ⱥ��������ݻ����ֲ���ʱ���о��÷�Ӧ�Ƿ�ﵽƽ��״̬��������λͬѧ��ƽ��״̬��������ȷ����__________��
A.�ף�H2���������ʵ���CH3OH����������
B.�ң������ڵ�ѹǿ���ֲ���
C.����������������ܶȱ��ֲ���
D.���������������ƽ��Ħ���������ֲ���
��2������һ���¶��¡��ݻ�Ϊ2L���ܱ������У�Ͷ��2 mol CO��4 mol H2�����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱH2ת����Ϊ75%����ƽ��ʱCH3OH��Ũ��=__________mol/L
��3����֪��298K��101kPa�£��״���ȼ���Ȼ�ѧ����ʽΪ��
CH3OH(l)+ 3/2 O2(g)= CO2(g)+ 2H2O(l) ��H= -725.8 kJ��mol-1��
CO��ȼ���Ȼ�ѧ����ʽΪ��CO(g)+ 1/2 O2(g)= CO2(g) ��H= -283 kJ��mol-1;
H2O (g) === H2O(l) ��H= -44 kJ��mol-1
��д���״�����ȫȼ������һ����̼��ˮ�������Ȼ�ѧ����ʽ__________��
��4���Լ״�Ϊȼ�ϣ�����Ϊ��������KOH��ҺΪ�������Һ�����Ƴ�ȼ�ϵ�أ��缫����Ϊ���Ե缫��
�ٸõ����ͨ��״����ǵ�Դ��__________������������������KOH��Һ��������д������ܷ�Ӧ�����ӷ���ʽ__________��
�����������Һ��KOH�����ʵ���Ϊ0.5mol������0.5mol�״����뷴Ӧʱ������ǡ��ΪKHCO3ʱ���õ�صĸ�����ӦʽΪ__________��������Һ�и������ӵ����ʵ���Ũ���ɴ�С��˳����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������֮��ķ�Ӧ�������й�ϵͼ��ͼ���������P��Ӧ��������������ȥ��
![]()
![]()
![]()
![]()
![]()
![]()
![]()
������ͼ�ı仯�����жϲ���ȷ����(����)
A. ��A�����Ρ�X��ǿ��ʱ��D����������������
B. ��X��ǿ����Һʱ��Bһ����NH3
C. B�����ǵ���
D. D������һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ��װ���ռ��������壺��H2����Cl2����O2����HCl����NO����SO2����NO2��
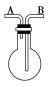
(1)����ƿ�Ǹ���ģ�����B�ڽ��������ռ���������________������A�ڽ��������ռ���������________��
(2)������ƿ�ڳ���ˮ�����ռ���������________������Ӧ��________�ڽ��롣
(3)����ƿ��װ������Ũ���ᣬ���������������������________������Ӧ��________�ڽ��롣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г��ӷ���ѡ�ô������
����(������Ϊ����) | ���ӷ��� | |
A | ������(��) | ���� |
B | ��ϩ(SO2) | NaOH��Һ��ϴ�� |
C | ����(��ϩ) | ��ˮ����Һ |
D | ������Һ(NaCl) | ���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��X��Ϊ������Ԫ���γɵ����������ͼ��ʾת����ϵ(����������ͷ�Ӧ������ȥ)����֪A�ɶ����ڷǽ���Ԫ����ɣ�B����Ư�����ҹ����ֽ⡣��ش���������:
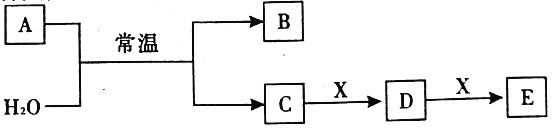
(1)��AΪ���ʣ���CΪһԪǿ�ᡣ
�ٻ�����B �ĽṹʽΪ_________��
��д��һ�ֹ�ҵ�Ʊ�����A�����ӷ���ʽ:__________��
��X����Ϊ_______(����ĸ����)��
a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)��AΪ����Ԫ���γɵĻ������E��ˮ��Ӧ���ɵ�G��Ũ��Һ��C�а��̲�����
��A�ĵ���ʽΪ_________��
��A��H2O��Ӧ�Ļ�ѧ����ʽΪ_________��
��������,NH2OH(�ǰ�)�ᷢ���ֽ�����C��D����д����ֽⷴӦ�Ļ�ѧ����ʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ҩѧ�����������������ؼ��俹ű��Ч���ٻ�ŵ��������ѧ��ҽѧ���������ؽṹʽ����ͼ��ʾ�������й��������о���˵������ȷ����
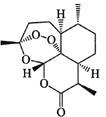
A. ��ȡ����Ϊ��ֹ�ƻ������ؽṹӦ������£����õͷе��ܼ����ѽ�����ȡ
B. ��ʹ�ú�����ײ��������ӵ���Է���������Ҳ����������ȷ��������ӵĻ�״�ṹ
C. ��������֬���Եģ��ȿɿ���������Ҳ�ɿ������������������������л�ԭ��
D. Ԫ�ط����ǿ���ȷ�����������Ƿ���C��H��O��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������NaHCO3��Na2O2�Ļ��������һ�ܱ������г�ּ��ȣ���Ӧ��ת�Ƶĵ�����Ϊ1mol������˵��һ����ȷ���ǣ�������
A. �������NaHCO3��Na2O2���ʵ���һ�����
B. �����п϶���0.5molO2
C. ��Ӧ�������еĹ���ֻ��Na2CO3
D. ��Ӧ��������һ��û��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ��������������������У��ס��ҡ����о�����ij����ͬ��Ԫ�أ�����֮�������ͼ��ʾת����ϵ(��Ӧ���������ֲ�������ȥ)�������й����ʵ��ƶϲ���ȷ����(����)

ѡ�� | ���� | ���� |
A | ��ΪAl(OH)3 | ������������ |
B | ��ΪNa2CO3��Һ | �������CO2 |
C | ��ΪFe | ������������ |
D | ��ΪN2 | ����������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com