
【题目】化学中有许多物质之间的反应符合下列关系图,图中其他产物及反应所需条件均已略去。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
对于上图的变化下列判断不正确的是( )
A. 当A是正盐、X是强酸时,D可能是酸性氧化物
B. 当X是强碱溶液时,B一定是NH3
C. B可能是单质
D. D可能是一种酸
科目:高中化学 来源: 题型:
【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
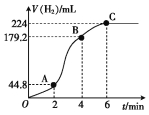
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着核电荷数的递增,氧化性逐渐减弱的一组是( )
A.I2、Br2、Cl2、F2B.F2、Cl2、Br2、I2C.F-、Cl-、Br-、I-D.Li、Na、K、Rb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1 mol/L NaOH溶液滴入20.00 mL 0.1 mol/L HA溶液,溶液pH随加入NaOH溶液体积的变化曲线如图所示。
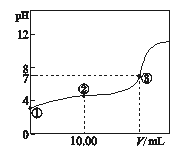
其中不正确的是 ( )
A. ①点:由水电离出的c(H+)=1×10-3mol/L
B. ②点:c(A-)>c(Na+)>c(H+)>c(OH-)
C. ③点:c(Na+)=c(A-)>c(H+)=c(OH-)
D. ③点加入NaOH溶液的体积小于20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2 g Cu投入100 mL稀硫酸中加热,没有明显变化,若边加热边缓缓加入一定量H2O2,金属Cu逐渐溶解,则下列说法正确的是( )
A. 反应过程中有刺激性气味的气体生成
B. H2O2对Cu和稀硫酸的反应起催化作用
C. 若Cu和硫酸恰好完全反应,则稀硫酸的物质的量浓度为0.5 mol·L-1
D. 反应中硫酸既表现出酸性又表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如右图所示。据图判断正确的是
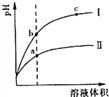
A. Ⅱ为盐酸稀释时的pH值变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移的方向和数目:_______________________________________。
(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面_______________________,则发生了钝化;若铁棒表面____________________,则未发生反应。
(3)用Na2SO3吸收法是治理SO2污染的一种方法,其原理为(用化学方程式表示): _______________________________________________________________。
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检测熟肉中NaNO2含量,某兴趣小组从1 000 g 隔夜熟肉中提取NaNO3和NaNO2后配成溶液,用0.005 00 mol·L-1的高锰酸钾(酸性)溶液滴定。平行测定三次,求出每次NaNO2含量,取其平均值。(已知:2MnO![]() +5NO
+5NO![]() +6H+===2Mn2++5NO
+6H+===2Mn2++5NO![]() +3H2O)
+3H2O)
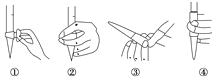
(1)滴定前排气泡时,应选择图中的________(填序号)。滴定时,高锰酸钾溶液盛放在___________________。
(2)滴定终点的判断依据为__________________________________。
(3)下列操作会导致样品含量测定值偏高的是__________________(填序号)。
a.锥形瓶用蒸馏水洗后未用待测液润洗
b.酸式滴定管用蒸馏水洗后未用标准液润洗
c.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
d.滴定前平视读数,滴定结束仰视读数
(4)某次滴定过程中,消耗高锰酸钾溶液的体积为16.00 mL。则此次求得的NaNO2的含量为________mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4-+H+ ka1 HC2O4-
HC2O4-+H+ ka1 HC2O4-![]() C2O42-+H+
C2O42-+H+![]() 常温下向某浓度的草酸溶液中逐滴加入一定量浓度KOH溶液,所得溶液H2C2O4、HC2O4-、C2O42-三种微粒物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
常温下向某浓度的草酸溶液中逐滴加入一定量浓度KOH溶液,所得溶液H2C2O4、HC2O4-、C2O42-三种微粒物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
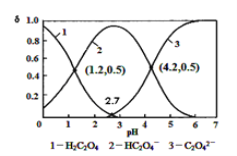
A. pH=1.2溶液中:c(K+)+c(H+) = c(OH-)+c(H2C2O4)(由图知)
B. pH=2.7溶液中: 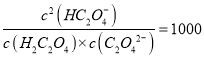
C. 将相同物质的量KHC2O4和K2C2O4固体溶于水可配得pH为4.2混合液
D. 向pH=1.2溶液中滴加KOH溶液,pH增大至4.2的过程中水电离程度一直增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com