
【题目】下列除杂方法选用错误的是
物质(括号内为杂质) | 除杂方法 | |
A | 硝基苯(苯) | 蒸馏 |
B | 乙烯(SO2) | NaOH溶液,洗气 |
C | 己烷(己烯) | 溴水,分液 |
D | 淀粉溶液(NaCl) | 渗析 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2 g Cu投入100 mL稀硫酸中加热,没有明显变化,若边加热边缓缓加入一定量H2O2,金属Cu逐渐溶解,则下列说法正确的是( )
A. 反应过程中有刺激性气味的气体生成
B. H2O2对Cu和稀硫酸的反应起催化作用
C. 若Cu和硫酸恰好完全反应,则稀硫酸的物质的量浓度为0.5 mol·L-1
D. 反应中硫酸既表现出酸性又表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移的方向和数目:_______________________________________。
(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面_______________________,则发生了钝化;若铁棒表面____________________,则未发生反应。
(3)用Na2SO3吸收法是治理SO2污染的一种方法,其原理为(用化学方程式表示): _______________________________________________________________。
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验、反应物用量和反应停止的时间数据如下表:
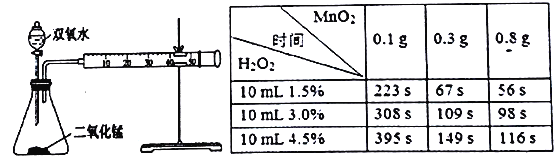
请回答下列问题:
(1)盛装双氧水的化学仪器名称是__________。
(2)如何检验该套装置的气密性__________。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而___________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入_______g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越大,所需要的时间就越长,其反应速率越慢”的结论,你认为是否正确___________,理由是_________。(提示:H2O2的密度可认为近似相等)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检测熟肉中NaNO2含量,某兴趣小组从1 000 g 隔夜熟肉中提取NaNO3和NaNO2后配成溶液,用0.005 00 mol·L-1的高锰酸钾(酸性)溶液滴定。平行测定三次,求出每次NaNO2含量,取其平均值。(已知:2MnO![]() +5NO
+5NO![]() +6H+===2Mn2++5NO
+6H+===2Mn2++5NO![]() +3H2O)
+3H2O)
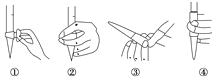
(1)滴定前排气泡时,应选择图中的________(填序号)。滴定时,高锰酸钾溶液盛放在___________________。
(2)滴定终点的判断依据为__________________________________。
(3)下列操作会导致样品含量测定值偏高的是__________________(填序号)。
a.锥形瓶用蒸馏水洗后未用待测液润洗
b.酸式滴定管用蒸馏水洗后未用标准液润洗
c.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
d.滴定前平视读数,滴定结束仰视读数
(4)某次滴定过程中,消耗高锰酸钾溶液的体积为16.00 mL。则此次求得的NaNO2的含量为________mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用如图装置进行NO、NO2的性质实验,按下列步骤进行(装置气密性已检验完毕)。
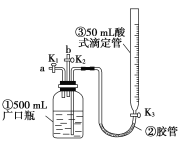
Ⅰ.向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加水的主要操作为____________________________。
(2)从导管a通入一定量的NO,并测得NO体积为V L(V<0 mL,气体体积已经换算为标准状况)。测定NO体积的主要操作为_______________________________。
Ⅱ.验证NO的还原性;探究工业生产硝酸的原理
(3)停止通入NO后关闭K1、K3;打开K2,从导管b缓缓通入O2,可观察到的现象是___________________________________________________________;
写出对应现象的化学方程式:________________________________。
(4)继续通入O2,打开K3,并及时调整酸式滴定管③中液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体。
①当通入氧气的体积为![]() 时,则广口瓶①的气体体积为________;
时,则广口瓶①的气体体积为________;
②当广口瓶①中刚好充满液体时,所得液体的物质的量浓度为_____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的容器中,反应2X(g)![]() Y(g)+2Z(g)达到平衡时,X、Y和Z的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向右移动的是
Y(g)+2Z(g)达到平衡时,X、Y和Z的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向右移动的是
A. 均减少1mol B. 均增加1mol C. 均减半 D. 均加倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A. 7.1 g Cl2与足量的NaOH溶液反应生成NaClO转移的电子数为0.1NA
B. 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子的数目为NA
C. 常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D. 足量Fe与22.4 L Cl2反应,转移电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com