
����Ŀ���й�ҩѧ�����������������ؼ��俹ű��Ч���ٻ�ŵ��������ѧ��ҽѧ���������ؽṹʽ����ͼ��ʾ�������й��������о���˵������ȷ����
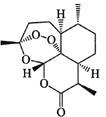
A. ��ȡ����Ϊ��ֹ�ƻ������ؽṹӦ������£����õͷе��ܼ����ѽ�����ȡ
B. ��ʹ�ú�����ײ��������ӵ���Է���������Ҳ����������ȷ��������ӵĻ�״�ṹ
C. ��������֬���Եģ��ȿɿ���������Ҳ�ɿ������������������������л�ԭ��
D. Ԫ�ط����ǿ���ȷ�����������Ƿ���C��H��O��Ԫ��
���𰸡�B
��������A�����й��������������ڸ������ֽ⣬Ӧ�ڵ����½��з��룬��A��ȷ��B��������ͨ���ʺɱ�ȷ����Է�����������������ܲⶨһ���л����Ƿ��й�����ϵ����ṹ����ȷ����״�ṹ����B������C�����й����������������ԣ��л���һ�㶼��ȼ�գ����������Ҳ���л�ԭ�ԣ���C��ȷ��D��Ԫ�ط����ǿ�ȷ��Ԫ�����࣬������ȷ�����������Ƿ���C��H��O��Ԫ�أ���D��ȷ����ѡB��


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ź˵�����ĵ�����������������һ���ǣ� ��
A.I2��Br2��Cl2��F2B.F2��Cl2��Br2��I2C.F����Cl����Br����I��D.Li��Na��K��Rb
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ܶ࣬����H2SO4��H2SO3��SO2��Na2SO3��BaSO4��CuSO4��Na2SO4��7�ֳ����ĺ�����ش��������⣺
(1)H2SO3ת��Ϊ�����������γɵ���Ҫ����֮һ��д���䷴Ӧ�Ļ�ѧ����ʽ������������ת�Ƶķ������Ŀ��_______________________________________��
(2)�����£�����������Ũ�����У����������α��Ͻ���Ϊ�����˶ۻ�����������Ϊδ������Ӧ��Ϊ��֤�˹��̣�ijͬѧ����˼�������������ʵ�飺����Ũ���ᴦ����������ϴ��������CuSO4��Һ�У�����������_______________________�������˶ۻ�������������____________________����δ������Ӧ��
(3)��Na2SO3���շ�������SO2��Ⱦ��һ�ַ�������ԭ��Ϊ(�û�ѧ����ʽ��ʾ)�� _______________________________________________________________��
(4)����SO2����Ⱦ�����Ϊ�����ҹ�����̽����һ����������CO��ԭSO2�õ�������ķ�������ȥSO2���÷�Ӧ�Ļ�ѧ����ʽ��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˼��������NaNO2������ij��ȤС���1 000 g ��ҹ��������ȡNaNO3��NaNO2�������Һ����0.005 00 mol��L��1�ĸ������(����)��Һ�ζ���ƽ�вⶨ���Σ����ÿ��NaNO2������ȡ��ƽ��ֵ��(��֪��2MnO![]() ��5NO
��5NO![]() ��6H��===2Mn2����5NO
��6H��===2Mn2����5NO![]() ��3H2O)
��3H2O)
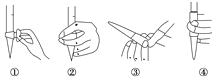
��1���ζ�ǰ������ʱ��Ӧѡ��ͼ�е�________(�����)���ζ�ʱ�����������Һʢ����___________________��
��2���ζ��յ���ж�����Ϊ__________________________________��
��3�����в����ᵼ����Ʒ�����ⶨֵƫ�ߵ���__________________(�����)��
a����ƿ������ˮϴ��δ�ô���Һ��ϴ
b����ʽ�ζ���������ˮϴ��δ�ñ�Һ��ϴ
c���ζ�����������ƿʱ��������������Һ����
d���ζ�ǰƽ�Ӷ������ζ��������Ӷ���
��4��ij�εζ������У����ĸ��������Һ�����Ϊ16.00 mL����˴���õ�NaNO2�ĺ���Ϊ________mg��kg��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�С��������ͼװ�ý���NO��NO2������ʵ�飬�����в������(װ���������Ѽ������)��
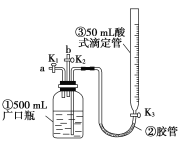
��.����ƿ����ͨ��NO���ⶨNO�����
(1)ͨ��NOǰ������ƿ���м�ˮ����Ҫ����Ϊ____________________________��
(2)�ӵ���aͨ��һ������NO�������NO���ΪV L(V��0 mL����������Ѿ�����Ϊ��״��)���ⶨNO�������Ҫ����Ϊ_______________________________��
��.��֤NO�Ļ�ԭ�ԣ�̽����ҵ���������ԭ��
(3)ֹͣͨ��NO��ر�K1��K3����K2���ӵ���b����ͨ��O2���ɹ۲쵽��������___________________________________________________________��
д����Ӧ����Ļ�ѧ����ʽ��________________________________��
(4)����ͨ��O2����K3������ʱ������ʽ�ζ��ܢ���Һ������ƿ����Һ����ƽ��ֱ�����ƿ���иպó���Һ�塣
�ٵ�ͨ�����������Ϊ![]() ʱ������ƿ�ٵ��������Ϊ________��
ʱ������ƿ�ٵ��������Ϊ________��
�ڵ����ƿ���иպó���Һ��ʱ������Һ������ʵ���Ũ��Ϊ_____mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaNO2��һ��ʳƷ���Ӽ��������°�������KMnO4��Һ��NaNO2��Ӧ�����ӷ���ʽ��MnO4����NO2����A�D��Mn2����NO��H2O(δ��ƽ)��������������ȷ����(����)
A. �÷�Ӧ��NO2������ԭ
B. ��Ӧ��������Һ��pH��С
C. ��Ӧ����1 mol NO������0.4 mol MnO4��
D. A��OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ�ݻ��ɱ�������У���Ӧ2X(g)![]() Y(g)��2Z(g)�ﵽƽ��ʱ��X��Y��Z�����ʵ����ֱ�Ϊ6mol��3mol��6mol�������¶Ⱥ�ѹǿ���䣬��ƽ�����������ߵ����ʵ��������µ�������ʹƽ�������ƶ�����
Y(g)��2Z(g)�ﵽƽ��ʱ��X��Y��Z�����ʵ����ֱ�Ϊ6mol��3mol��6mol�������¶Ⱥ�ѹǿ���䣬��ƽ�����������ߵ����ʵ��������µ�������ʹƽ�������ƶ�����
A. ������1mol B. ������1mol C. ������ D. ���ӱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ϊ��Ԫ���H2C2O4![]() HC2O4��+H+ ka1 HC2O4��
HC2O4��+H+ ka1 HC2O4��![]() C2O42��+H+
C2O42��+H+![]() ��������ijŨ�ȵIJ�����Һ����μ���һ����Ũ��KOH��Һ��������ҺH2C2O4��HC2O4����C2O42�����������ʵ�����������������ҺpH�Ĺ�ϵ��ͼ��ʾ��������˵���в���ȷ����
��������ijŨ�ȵIJ�����Һ����μ���һ����Ũ��KOH��Һ��������ҺH2C2O4��HC2O4����C2O42�����������ʵ�����������������ҺpH�Ĺ�ϵ��ͼ��ʾ��������˵���в���ȷ����
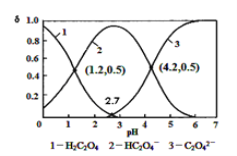
A. pH=1.2��Һ�У�c��K+����c��H+�� = c��OH������c��H2C2O4������ͼ֪��
B. pH=2.7��Һ�У� 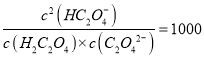
C. ����ͬ���ʵ���KHC2O4��K2C2O4��������ˮ�����pHΪ4.2���Һ
D. ��pH=1.2��Һ�еμ�KOH��Һ��pH������4.2�Ĺ�����ˮ����̶�һֱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. �к͵����pH=2�����ᡢ���ᡢ���������������Ƶ����ʵ�����ϵΪ��CH3COOH>H2SO4>HCl
B. ����FeSO4��Һʱ������ϡHNO3������Fe2+ˮ��
C. ��FeCl3��Һ���ɡ����������أ����յõ�FeCl3����
D. ����ˮ���ȵĹ����У�Kw���pH��С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com