
【题目】下列说法中正确的是
A. 中和等体积pH=2的盐酸、硫酸、醋酸所需氢氧化钠的物质的量关系为:CH3COOH>H2SO4>HCl
B. 保存FeSO4溶液时,加入稀HNO3,抑制Fe2+水解
C. 将FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D. 将纯水加热的过程中,Kw变大,pH变小
【答案】D
【解析】A.盐酸和硫酸都是强酸,pH=2的盐酸、硫酸溶液中c(H+)相等,则二者等体积时消耗NaOH的物质的量相等,醋酸是弱酸,等pH的醋酸和盐酸、硫酸相比,醋酸的浓度大于盐酸和硫酸的浓度,则所需NaOH的物质的量最大,即所需NaOH的物质的量关系为:CH3COOH>H2SO4=HCl,故A错误;B. 硝酸是强氧化性酸,加入稀HNO3可将Fe2+氧化成Fe3+,应加稀硫酸,故B错误;C. 在FeCl3溶液中,Fe3+发生水解反应FeCl3+3H2OFe(OH)3+3HCl,由于加热使HCl挥发,平衡不断向右移动,生成Fe(OH)3,又因为灼烧时发生2Fe(OH)3![]() Fe2O3+3H2O,使Fe(OH)3分解生成Fe2O3,则最终所得固体为Fe2O3,故C 错误;D. 将纯水加热的过程中促进水的电离,Kw变大,氢离子浓度变大,pH变小,故D正确;答案选D。
Fe2O3+3H2O,使Fe(OH)3分解生成Fe2O3,则最终所得固体为Fe2O3,故C 错误;D. 将纯水加热的过程中促进水的电离,Kw变大,氢离子浓度变大,pH变小,故D正确;答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】中国药学家屠呦呦因发现青蒿素及其抗疟疗效,荣获诺贝尔生理学或医学奖。青蒿素结构式如右图所示,下列有关青蒿素研究的说法不正确的是
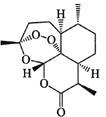
A. 提取过程为防止破坏青蒿素结构应避免高温,故用低沸点溶剂乙醚进行萃取
B. 可使用红外光谱测出这个分子的相对分子质量,也可用质谱仪确定这个分子的环状结构
C. 青蒿素是脂溶性的,既可看作是醚类也可看作是酯类化合物,既有氧化性又有还原性
D. 元素分析仪可以确定青蒿素中是否含有C、H、O等元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈(Fe2O3)。现将一表面生锈的铁件放入盐酸中,除去铁锈的化学反应的离子方程式为:___________。
(2)利用如图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时, 转移的电子数为_______NA。
(4)铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )

选项 | 假设 | 结论 |
A | 甲为Al(OH)3 | 丁可能是盐酸 |
B | 甲为Na2CO3溶液 | 戊可能是CO2 |
C | 甲为Fe | 丁可能是盐酸 |
D | 甲为N2 | 戊可能是氧气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++ H2O2 +2H+= 2Fe3++2H2O
B. 用食醋除水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C. 向NaClO溶液中通入少量SO2: 2C1O-+SO2+H2O=SO32-+2HClO
D. Na2S溶于水呈碱性:S2-+ 2H2O![]() H2S +2OH-
H2S +2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中为了延长鲜花的寿命,通常会在花瓶中加入鲜花保鲜剂。下表是0.5 L某种鲜花保鲜剂中含有的成分及含量,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖(C12H22O11) | 25.00 | 342 |
硫酸钾(K2SO4) | 0.25 | 174 |
高锰酸钾(KMnO4) | 0.25 | 158 |
阿司匹林(C9H8O4) | 0.17 | 180 |
硝酸银(AgNO3) | 0.02 | 170 |
(1)鲜花保鲜剂的下列成分中,属于电解质的是________(填字母)。
a.蔗糖 b.硫酸钾
c.高锰酸钾 d.硝酸银
(2)欲配制480 mL该鲜花保鲜剂,现已提供下列仪器:
①胶头滴管、②量筒、③烧杯、④药匙、⑤电子天平,如要完成实验,缺少的玻璃仪器还有________(写仪器名称)。
(3)写出该鲜花保鲜剂中K+的物质的量浓度的计算式:________(不必化简)。
(4)将m g蔗糖完全燃烧后的产物通过足量的Na2O2固体,充分反应后,固体增加的质量________(填“>”“=”或“<”)m g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L 0.1 mo1.L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是

A. M点溶液中水的电离程度比原溶液大
B. 随着NaOH的加入,NH4+与NH3·H2O物质的量总量减少
C. 当n(NaOH)=0.05mol时,溶液中有:c(C1-)>c(Na+>c(NH4+>c(OH-)>c(H+)
D. 在M点时,n(OH-)+0.05=a+n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中富含碘元素.从海带中提取碘有如下步骤:( )
①将海带焙烧成灰(生成KI) ②加水使KI溶解,充分搅拌后过滤 ③在滤液通入足量Cl2④加CCl4振荡⑤静置后,用分液漏斗分液 合理的操作顺序是.
A.①②③④⑤
B.②⑤①③④
C.①③⑤②④
D.②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法正确的是( )
物 质 | 除杂试剂 | 分离方法 | |
A | 硝酸铜溶液(硝酸银) | 铜粉 | 结晶 |
B | Cl2(HCl) | NaOH溶液 | 洗气 |
C | Br2(H2O) | 酒精 | 萃取 |
D | 铜粉(铁粉) | 稀盐酸 | 过滤 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com