
【题目】常温下,向1L 0.1 mo1.L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是

A. M点溶液中水的电离程度比原溶液大
B. 随着NaOH的加入,NH4+与NH3·H2O物质的量总量减少
C. 当n(NaOH)=0.05mol时,溶液中有:c(C1-)>c(Na+>c(NH4+>c(OH-)>c(H+)
D. 在M点时,n(OH-)+0.05=a+n(H+)
【答案】D
【解析】A.M点是向1L 0.1molL-1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离,此时水的电离程度小于原氯化铵溶液中水的电离程度,故A错误;B.1L0.lmolL-1NH4Cl溶液中,存在物料守恒c(NH4+)+c(NH3H20)=0.1mol/L,随着NaOH的加入,NH4+与NH3·H2O物质的量总量不变,故B错误;C.向1L 0.1molL-1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.05mol时,得到物质的量均为0.05molNH4Cl、0.05molNaCl和0.05molNH3H2O的混合物,由于NH3H2O电离大于NH4Cl水解,故离子浓度大小关系为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故C错误;D.在M点时溶液中存在电荷守恒,n(0H-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(0H-)-n(H+)=0.05+n(Na+)-n(Cl-)=(a-0.05)mol,则n(OH-)+0.05=a+n(H+),故D正确;答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的容器中,反应2X(g)![]() Y(g)+2Z(g)达到平衡时,X、Y和Z的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向右移动的是
Y(g)+2Z(g)达到平衡时,X、Y和Z的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向右移动的是
A. 均减少1mol B. 均增加1mol C. 均减半 D. 均加倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A. 7.1 g Cl2与足量的NaOH溶液反应生成NaClO转移的电子数为0.1NA
B. 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子的数目为NA
C. 常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D. 足量Fe与22.4 L Cl2反应,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 中和等体积pH=2的盐酸、硫酸、醋酸所需氢氧化钠的物质的量关系为:CH3COOH>H2SO4>HCl
B. 保存FeSO4溶液时,加入稀HNO3,抑制Fe2+水解
C. 将FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D. 将纯水加热的过程中,Kw变大,pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2—氯苯甲醛为原料的合成路线如下:

(1)X(C6H7BrS)的结构简式为 。
(2)写出C聚合成高分子化合物的化学反应方程式 。(不需要写反应条件)
(3)已知:①  ②
②![]() 中氯原子较难水解,物质A(
中氯原子较难水解,物质A(![]() )可由2—氯甲苯为原料制得,写出以两步制备A的化学方程式___________________。
)可由2—氯甲苯为原料制得,写出以两步制备A的化学方程式___________________。
(4)物质G是物质A的同系物,比A多一个碳原子。符合以下条件的G的同分异构体共有 种。
①除苯环之外无其它环状结构;②能发生银镜反应
(5)已知:![]()
写出由乙烯、甲醇为有机原料制备化合物![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计从模拟海水中制备MgO的实验方案:
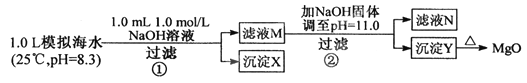
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
【注】溶液中某种离子的浓度小于1.0![]() 10-5mol
10-5mol![]() L-,可认为该离子不存在。
L-,可认为该离子不存在。
实验过程中,假设溶液体积不变。已知:
Ksp(CaCO3)=4.96![]() 10-9 Ksp(MgCO3)=2.1
10-9 Ksp(MgCO3)=2.1![]() 10-5
10-5
Ksp(Ca(OH)2)=4.68![]() 10-6 Ksp(Mg(OH)2)=5.61
10-6 Ksp(Mg(OH)2)=5.61![]() 10-12
10-12
下列说法正确的是
A. 沉淀物x为CaCO3
B. 滤液M中存在Mg2+ ,不存在Ca2+
C. 滤液N中存在Mg2+ , Ca2+
D. 步骤②中应改为加入4.2g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的有机化合物A(C6H6O)是重要的化工原料,在工业上能合成紫外线吸收剂BAD和治疗心脏病药物的中间体F,合成路线如下:
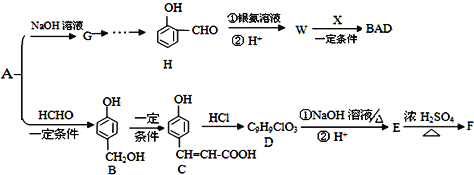
已知:BAD的结构简式为: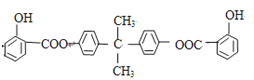
F的结构简式为: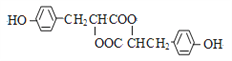
试回答:
(1)H中含有的官能团名称是____________________。
(2)写出X的结构简式____________________________________,推测B的核磁共振氢谱中显示有__________种不同化学环境的氢原子。
(3)写出反应类型A→B______________;W→BAD______________。
(4)1mol C可以和______________mol Br2反应。
(5)C→D的过程中可能有另一种产物C1,请写出在加热条件下C1与足量稀NaOH水溶液反应的化学方程式:__________________________。
(6)B与HCHO在一定条件下反应生成高分子化合物的原理,与酚醛树脂的制备原理相似。请写出该反应的化学方程式___________________。
(7)W的同分异构体有多种,写出所有符合以下要求的W的同分异构体:________________。
①与FeCl3溶液反应,溶液呈紫色; ②能发生银镜反应;③苯环上的一氯代物只有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有21.6 g由CO和CO2组成的混合气体,在标准状况下其体积为13.44 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)混合气体中碳原子的质量为________。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
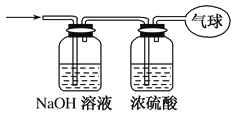
①气球中收集到的气体的摩尔质量为________。
②气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
③气球的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各对物质属于同系物的是( )
A. CH2=CHCH3和CH2=CH2 B. CH2ClCH3和CH2ClCH(CH3)CH2Cl
C. CH2=CH2和![]() D. 12C和14C
D. 12C和14C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com